abstract
Endomorfina-2 (Tyr-Pro-Phe-Phe-NH 2; EM-2) și endomorfina-1 (Tyr-Pro-Trp-Phe-NH 2; EM-1) sunt izolate de la bovine (Zadina și colab., 1997) ca și creierul uman (Hackler și colab., 1997) și sunt considerați liganzi endogeni pentru receptorul mu-opioid (Goldberg și colab., 1998; Zadina și colab., 1997). Imunoreactivitatea EM-2 și EM-1 este prezentă în mod vizibil în zonele în care receptorii mu sunt concentrați. Cantități mari de imunoreactivitate de tip EM-2 (Schreff și colab., 1998) și imunoreactivitate de tip EM-1 (Martin-Schild și colab., 1999) au fost găsite în nucleul accumbens (NAc), care conține diferite subtipuri de opiacee . receptori (receptori mu-, kappa și delta-opioizi). Din punct de vedere farmacologic, aceste două endomorfine sunt analgezice puternice și prezintă proprietăți similare (Goldberg și colab., 1998). Atât EM-2 cât și EM-1 produc antinociceptii sensibile la naloxonă cu acțiune scurtă în testul flick-ului cozii (Stone și colab., 1997). Cu toate acestea, studiile de intervenție farmacologică au arătat, de asemenea, că mecanismele de acțiune ale celor două endomorfine nu sunt complet identice. Astfel, efectul antinociceptiv al EM-2 este mai sensibil la naloxonazină decât EM-1 (Sakurada și colab., 1999, 2000, 2001, 2002). Studiile efectuate de Sakurada și colab. Au sugerat că EM-2 acționează predominant ca un agonist al receptorului opioid mu1 și EM-1 ca un agonist al receptorului opioid mu2.
Activarea receptorilor mu-opioizi în NAc induce o creștere mare și rapidă a efluxului de acumulare a dopaminei. Astfel, fentanilul, un agonist al receptorilor mu, crește efluxul reversibil de naloxonă de dopamină α-dopaminică (Yoshida și colab., 1999). Nu a fost studiată capacitatea EM-2 și EM-1 de a modifica cantitatea extracelulară de dopamină acumulată la șobolanii care se mișcă liber. Prin urmare, am analizat efectele EM-2 și EM-1 asupra cantității extracelulare de dopamină în NAc a șobolanilor în mișcare liberă, folosind o tehnică de microdializă recent îmbunătățită care permite monitorizarea on-line a dopaminei cu o rezoluție de timp de 5 minute. 20 min (Saigusa și colab., 2001; cf. Fusa și colab., 2002, 2005; Murai și colab., 1994; Saigusa și colab., 1997, 1999; Takada și colab., 1993; Tomiyama și colab., 1993 ., 1995).
PROCEDURI EXPERIMENTALE
Șobolani Sprague-Dawley masculi (NRC Haruna, Japonia) cu o greutate cuprinsă între 200 și 220 g au fost folosiți la începutul experimentului. Au fost plasate într-un mediu controlat de temperatură într-un ciclu lumină-întuneric de 12 ore (perioadă de lumină 0700-1900 h) cu acces gratuit la alimente și apă.
interventie chirurgicala
Șobolanii au fost anesteziați cu pentobarbitonă de sodiu (50 mg/kg, intraperitoneal (ip)). Animalele anesteziate au fost plasate într-un dispozitiv stereotaxic și o canulă de ghidare (AP 10,6 mm, ML 1,5 mm, DV 4,0 mm de la linia interaurală; Paxinos și Watson, 1998) a fost implantată chiar deasupra NAc stânga conform procedurilor descrise mai sus (Fusa și colab., 2002, 2005; Saigusa și colab., 1997, 1999, 2001). Pentru a evita sistemul ventricular, canulele îndreptate spre NAc au fost înclinate la 18 ° de la planul sagital median. La sfârșitul intervenției chirurgicale, șobolanilor li s-a permis să se recupereze cu 7-10 zile înainte de experimente; canulele de ghidare au fost brevetate folosind inserții din oțel inoxidabil. Fiecare animal a fost folosit o singură dată. Experimentele au fost efectuate în conformitate cu orientările instituționale, naționale și internaționale pentru îngrijirea și bunăstarea animalelor. S-au depus toate eforturile pentru a reduce la minimum suferința animalelor și pentru a reduce numărul de animale utilizate.
Dializă și măsurători neurochimice
droguri
Medicamentele utilizate au fost EM-2 (Peptide Institute Inc., Osaka, Japonia), EM-1 (Peptide Institute Inc., Osaka, Japonia), TTX (Sigma-RBI, St. Louis, MO, SUA), CTOP (Sigma -RBI St Louis, MO, SUA), naloxonă (Sigma-RBI, St Louis, MO, SUA) și naloxonazină (diclorhidrat de naloxonazină; Sigma-RBI, St Louis, MO, SUA). EM-2, EM-1 și CTOP au fost dizolvate în soluția Ringer modificată. EM-2 și EM-1 au fost perfuzate prin membrana de dializă timp de 25 de minute, în timp ce CTOP a fost perfuzat în mod similar timp de 50 de minute (începând cu 25 de minute înainte de perfuzia EM-2 și EM-1). Blocantul canalului de sodiu TTX a fost, de asemenea, dizolvat în soluția Ringer modificată pentru utilizare în perfuzie și administrat intracerebral printr-o sondă de dializă. Naloxona a fost dizolvată în soluție salină. Naloxonazina a fost suspendată în soluție de 2,5% Tween-80 și administrată cu 24 de ore înainte de începerea perfuziei EM-2. Dozele utilizate s-au bazat pe rezultatele experimentelor de mai sus (EM-2 și EM-1: Sakurada și colab., 2001; TTX: Fusa și colab., 2002; Saigusa și colab., 2001; Takada și colab., 1993; Tomiyama și colab. Și colab., 1993, 1995, CTOP: Yoshida și colab., 1999, naloxonă: Yoshida și colab., 1999, naloxonazină: Piepponen și Ahtee, 1995). Dozele raportate de EM-2 și EM-1 au fost cantitatea (nmol) de compuși în 25 de minute de fluid de perfuzie (50 μl), iar doza de CTOP a fost cantitatea de compus în 50 de minute de fluid de perfuzie (100 μl).
histologie
La sfârșitul experimentului, șobolanii au fost anesteziați profund cu pentobarbitonă de sodiu (50 mg/kg, ip) și spălați transcardial cu soluție de formaldehidă 10%. Creierul a fost îndepărtat, secționat (50 μm) și colorat cu violet crezil pentru a permite plasarea sondei.
analize statistice
Toate valorile au fost exprimate ca procent din nivelurile de bază. Compararea datelor cursului de timp a fost efectuată utilizând un ANOVA bidirecțional (analiza varianței) pentru măsuri repetate cu tratament și factori de timp (repetat). Semnificația statistică a fost considerată P 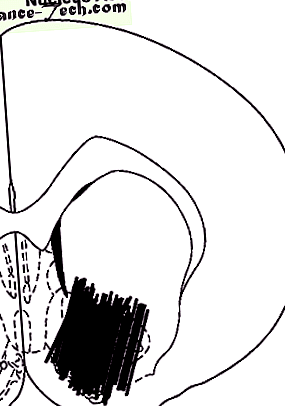
Reprezentarea schematică a locației sondei în NAc. Diagrama este preluată din Atlasul Paxinos și Watson; numărul reprezintă distanța anterioară (mm) față de linia interaurală.
Imagine la dimensiune completă
Nivelul bazal al dopaminei extracelulare în NAc
Concentrația inițială de dopamină în dializații NAc a fost de 1,0 ± 0,05 pg/5 min (medie ± SEM; n = 159).
Efectele perfuziei EM-2 și EM-1 asupra nivelurilor de dopamină extracelulară din NAc
Infuzie de 25 de minute de EM-2 (Figura 2a; 5 nmol (n = 7), 25 nmol (n = 6) și 50 nmol (n = 6)) sau EM-1 (Figura 2b; 5 nmol (n = 6) )), 25 nmol (n = 6) și 50 nmol (n = 6) la NAc au indus o creștere dependentă de doză a nivelurilor de dopamină extracelulară într-o manieră dependentă de doză: aceste efecte au durat aproximativ 10-35 minute (EM-2 - tratamentul F (2, 96) = 84, 92, P
a) Efectele infuziei vehiculului (n = 6, umplut cu diamante), 5 nmol EM-2 (n = 7, pătrate deschise), 25 nmol EM-2 (n = 6, triunghiuri umplute) și 50 nmol EM-2 2 (n = 6, cercuri deschise) la NAc la nivelurile bazale de dopamină extracelulară (DA) în NAc. Datele sunt exprimate ca schimbare medie pe perioade de observație de 5 minute după începutul perfuziei EM-2 de 25 de minute. Liniile verticale indică SEM. Bara umplută deasupra axei x indică timpul de perfuzie al vehiculului sau EM-2. b) Efectele infuziei vehiculului (n = 6, umplut cu diamante), 5 nmol EM-1 (n = 6, pătrate deschise), 25 nmol EM-1 (n = 6, triunghiuri umplute) și 50 nmol EM-1 1 (n = 6, cercuri deschise) la NAc la nivelurile bazale de dopamină extracelulară (DA) în NAc. Datele sunt exprimate ca schimbare medie în perioadele de observare de 5 minute după debutul unei infuzii de 25 de minute de EM-1. Liniile verticale indică SEM. Bara umplută deasupra axei x indică timpul de perfuzie al vehiculului sau EM-1.
Imagine la dimensiune completă
Dependența neuronală a creșterii tranzitorii a efluxului de dopamină indusă de EM-2 și EM-1 în NAc
TTX (2 μM) perfuzat timp de 2 ore printr-o sondă de dializă a redus nivelurile bazale de DA cu aproximativ 70%. Această infuzie TTX a abolit aproape complet EM-2 (50 nmol; n = 6; Figura 3a; tratamentul F (1, 60) = 421, 58: P
(a) Efectele perfuziei a 2 μM TTX pe o infuzie de 25 de minute de 50 nmol EM-2 indusă de creșterea nivelurilor DA (dopamină) în NAc (n = 6, triunghiuri deschise). Datele sunt exprimate ca schimbare medie pe perioade de observație de 5 minute după începutul perfuziei EM-2 de 25 de minute. Liniile verticale indică SEM. Lanseta deschisă deasupra axei x arată perioada de perfuzie TTX care a început cu 120 de minute înainte de începerea perfuziei EM-2. Linia umplută indică timpul de perfuzie al EM-2. (b) Efectele perfuziei a 2 μM TTX pe o infuzie de 25 de minute de 50 nmol EM-1 indusă de creșterea nivelurilor DA (dopamină) în NAc (n = 6, triunghiuri deschise). Datele sunt exprimate ca schimbare medie în perioadele de observație de 5 minute după debutul unei perfuzii de 25 de minute de EM-1. Liniile verticale indică SEM. Lanseta deschisă deasupra axei x arată perioada de perfuzie TTX care a început cu 120 de minute înainte de începerea perfuziei EM-1. Linia umplută indică timpul de perfuzie al EM-1.
Imagine la dimensiune completă
Efectele antagonistului receptorului Mu-opioid asupra creșterii tranzitorii a efluxului de dopamină indus de EM-2- și EM-1 în NAc
Perfuzia NAc cu antagonistul receptorului mu-opioid CTOP (3 nmol; n = 6) nu a afectat perfuzia intra-acumulată a creșterii cantității extracelulare a acumulării de dopamină indusă de EM-2 (50 nmol; n = 6). (Figura 4a; tratamentul F (1, 57) = 3, 28, P = 0,08; timpul F (5, 57) = 5, 30, P
Imagine la dimensiune completă
Efectele naloxonei asupra creșterii tranzitorii a fluxului de dopamină indus de EM-2- și EM-1 în NAc
Așa cum se arată în Figura 5a, naloxona (1 mg/kg, ip, administrată cu 20 de minute înainte de perfuzia intracerebrală), care în sine nu a afectat semnificativ nivelurile bazale de dopamină acumulată (datele nu sunt prezentate), nu au afectat EM-2 (50 nmol ) indusă de creșterea nivelului de dopamină în NAc (n = 6). Pentru a crește eficacitatea așteptată a naloxonei, naloxona a fost administrată cu 10 în loc de 20 de minute înainte de administrarea EM-2; Naloxona a fost din nou pe deplin capabilă să inhibe efectele EM-2 (50 nmol) asupra nivelurilor de dopamină din NAc (Figura 5b, n = 9). După cum sa menționat mai sus, 25 nmol EM-1 produce efecte mai mult sau mai puțin comparabile cu efectele 50 nmol EM-2. Prin urmare, am testat inițial capacitatea naloxonei (1 mg/kg, ip, administrată cu 10 minute înainte de perfuzia intracerebrală), care în sine nu a afectat în mod semnificativ nivelurile bazale de dopamină acumulată (date neprezentate), de a antagoniza 25 nmol EM -1 . Acest tratament a redus semnificativ creșterile induse de EM-1 ale nivelurilor de dopamină (25 nmol) în NAc, în special în perioada inițială de 10 până la 30 de minute (n = 9; Figura 5c; tratamentul F (1, 78) = 42, 49, P
Imagine la dimensiune completă
DISCUŢIE
Am arătat anterior că nivelurile de bază ale dopaminei în NAc depind în mare măsură de activitatea neuronală, deoarece mai mult de 70% din eliberarea de dopamină este sensibilă la TTX (Saigusa și colab., 2001). Prin urmare, se crede că dopamina bazală măsurată în acest studiu se datorează în primul rând eliberării dopaminei de către neuroni.
Infuzia intraacrală de EM-2 și EM-1 a crescut în funcție de doză nivelurile de dializat de dopamină de la șobolani NAc. S-a observat o diferență cantitativă între efectele EM-2 și EM-1 asupra inducerii unei creșteri a efluxului de acumulare a dopaminei. Astfel, capacitatea EM-2 de a crește nivelurile acumulate de dopamină extracelulară a fost mult mai mică decât capacitatea EM-1 atunci când a fost testată pentru o gamă largă de doze (5, 25 și 50 nmol). Efectele maxime ale celei mai mari doze (50 nmol) de perfuzie de EM-2 și EM-1 au fost aproape complet suprimate prin perfuzie intra-acumulată de TTX (2 μM), sugerând că în condițiile experimentale actuale, creșterea nivelurilor acumulate de dopamină induse prin EM-2- și EM-1 a fost complet dependent de activitatea neuronală. După cum sa discutat mai jos, efectele EM-1 au fost mediate de mecanisme care sunt complet diferite de mecanismele care mediază efectele EM-2. Prin urmare, diferențele de eficacitate între EM-1 și EM-2 nu pot fi atribuite pur și simplu unei diferențe de afinitate și/sau activitate intrinsecă, ci unei diferențe de mecanisme.
Luat împreună, acest studiu arată că perfuzia intra-acumulată de EM-2 și EM-1 crește efluxul de dopamină în NAc prin mecanisme care sunt complet diferite. Deși efectele EM-2 și EM-1 depind de activitatea neuronală, efectele EM-2 nu au putut fi blocate de o doză altfel eficientă de antagonist selectiv al receptorului muopioid CTOP sau de antagonistul receptorului opioid specific naloxonă, spre deosebire de efectele EM-1, care au fost suprimate foarte eficient CTOP, naloxonazină și naloxonă. S-a ajuns la concluzia că efectele EM-2 nu sunt mediate prin receptorii opioizi sensibili la naloxonă, spre deosebire de efectele EM-1, care sunt mediate de receptorii mu1-opioizi din NAc.
Mulțumiri
Acest studiu a fost susținut de granturi de cercetare din Fondul Sato (TS, NK) și Centrul de cercetare dentară (NK), Școala de Medicină Dentară a Universității Nihon; Bursa de cercetare multidisciplinară a Universității Nihon 2005/2006 (TS, NK, ARC); o subvenție pentru sprijinirea unui proiect de cercetare multidisciplinară (NK, ARC) și asistență pentru sprijinirea cercetării științifice (# 14 370 609 pentru NK și # 16 591 897 pentru TS) de la Ministerul Educației, Culturii, Sportului, Științei și Tehnologiei, Japonia; și Societatea de sprijin și asistență reciprocă pentru școala privată din Japonia (SW, IT, YA, NK).
