- obiecte
- abstract
- introducere
- Pacienți și metode
- pacienți
- Planul de transplant
- Evaluarea eficacității
- Evaluarea toxicității legate de transplant
- biostatistică
- Rezultatul
- Caracteristicile pacientului
- Obiective de eficacitate
- Toxicitate pentru palifermine
- Toxicitate legată de transplant
- OS și EFS
- discuţie
obiecte
- Transplant de măduvă osoasă
- chimioterapie
- Boli gastrointestinale
- Celulele stem hematopoietice
abstract
Palifermin, un factor recombinant de creștere a keratinocitelor umane, este administrat în mod obișnuit pentru a preveni mucozita după transplantul autolog. Datele de siguranță și eficacitate sunt limitate la transplanturile de celule stem hematopoietice alogene (alo-HSCT). Am efectuat un studiu retrospectiv pe 251 de pacienți care au fost supuși allo-HSCT, dintre care 154 au primit palifermina periflantă. La toți pacienții, paliferminul a redus semnificativ numărul mediu de zile de nutriție parenterală totală (TPN, 13 vs 16 zile, P = 0,006) și analgezia controlată de pacient (PCA, 6 vs 10 zile, P = 0,023), precum și durata șederii inițiale în spital (LOS, 32 vs 37 de zile, P = 0,014). Cu toate acestea, efectul paliferminei a fost semnificativ numai la pacienții cărora li s-a administrat un regim de chimioterapie bazat pe TBI, dar nu pe BU. La pacienții cu TBI, palifermin a redus numărul mediu de zile TPN (13 vs 17 zile, P 1 Deși severitatea poate varia în funcție de regimurile de condiționare, mucozita asociată cu alo-HSCT poate duce la morbiditate semnificativă, inclusiv dureri orale care necesită narcotice pentru analgezie, anorexie care necesită nutriție parenterală completă (TPN), ședere spitalizată prelungită și, posibil, infecții care pun viața în pericol, cauzate de bacterii mucoase translocate. 2, 3, 4
Factorul de creștere a cheratinocitelor este o proteină endogenă de 28 kDa dintr-o serie de factori de creștere a fibroblastelor care funcționează ca factor de creștere pentru celulele epiteliale. Factorul de creștere a cheratinocitelor joacă un rol important în vindecarea epitelială după rănire. 6 Palifermin (Kepivance, biovitru orfan suedez) este un factor recombinant de creștere a cheratinocitelor umane, care este mai stabil decât factorul de creștere endogen al keratinocitelor datorită îndepărtării a 23 de aminoacizi de la capătul său N-terminal (informații despre produs). Datele preclinice din modelele de șoareci au arătat că administrarea paliferminei protejează împotriva chimioterapiei și a mucozitei induse de radiații. 7, 8, 9, 10 S-a demonstrat clinic că Palifermin ameliorează mucozita după chimioterapie și HSCT autolog pe bază de TBI. 11, 12 Pe baza unui studiu de fază III la pacienți cu transplant autolog care au demonstrat o incidență și o durată reduse a mucozitei de gradul III-IV a Organizației Mondiale a Sănătății, după condiționarea TBI, Fif a aprobat palifermina pentru prevenirea mucozitei în timpul tratamentului autolog și alogen. HSCT. Cu toate acestea, există o experiență limitată publicată cu palifermin în legătură cu allo-HSCT. 13, 14, 15
Pentru a determina dacă palifermina este sigură și eficientă după alo-HSCT, am efectuat o analiză retrospectivă a experienței noastre cu palifermina administrată pacienților adulți supuși HSlat aloelo cu depleție de celule T mieloablative (TCD) pentru afecțiuni maligne hematologice. Setarea TCD a fost aleasă pentru a studia efectele paliferminei în absența MTX, care este frecvent utilizată pentru profilaxia GVHD. Deși TCD nu este utilizat în mod obișnuit în Statele Unite, datele pozitive recente de la mai multe centre susțin o utilizare mai largă. 16, 17 Acest studiu reprezintă cea mai mare experiență publicată până în prezent, cu detalii despre utilizarea paliferminei în timpul allo-HSCT.
Pacienți și metode
pacienți
Imagine la dimensiune completă
Planul de transplant
Celulele T au fost îndepărtate din grefele BM prin aglutinarea secvențială a lectinei din soia și epuizarea RBC ovine (nouă pacienți). 19 epuizarea celulelor T a G-CSF-urilor mobilizate de PBS a fost realizată prin selecția pozitivă a celulelor stem CD34 + utilizând un separator magnetic ISOLEX 300i urmat de epuizarea rozetei RBC ovine (231 pacienți), 20 sau selecția pozitivă a celulelor stem CD34 + folosind un sistem Miltenyi CliniMACS fără epuizarea ulterioară a rozetei RBC ovine (11 pacienți). 16 celule T sau PBSC epuizate din măduva osoasă au fost perfuzate în 24-48 de ore de la finalizarea chimioterapiei. Regimurile de condiționare au inclus globulina antitimocitară (ATG) pentru 0-3 doze. Profilaxia farmacologică a GVHD nu a fost furnizată, deoarece pacienții au primit o grefă TCD ex vivo complet.
Pacienții care au primit palifermină au primit medicamentul conform unui program de dozare aprobat. 12 Au fost administrate trei doze zilnice (60 mcg/kg/zi) înainte de admitere pentru transplant, a treia doză administrată cu cel puțin 24 de ore înainte de chimioterapie sau radioterapie. De la 6 ore după perfuzia cu celule stem, pacienții au primit încă trei doze zilnice suplimentare de palifermină (60 mcg/kg/zi).
Evaluarea eficacității
Datele au fost colectate cu privire la numărul de zile în care pacienții au avut nevoie de TPN și analgezie controlată de pacient (PCA) cu narcotice. 12, 14 Pacienții au fost tratați cu PCA de către medicul curant după transplant, atunci când pacienții s-au plâns de orice durere la nivelul gurii sau gâtului care ar interfera cu înghițirea. PCA a fost întreruptă atunci când pacientul nu a necesitat „dozele necesare” în absența unei doze bazale. Procesul nostru de management TPN este descris mai sus. Durata șederii inițiale în spital (LOS) după transplant de la internare a fost, de asemenea, determinată pentru toți pacienții.
Evaluarea toxicității legate de transplant
Diagnosticul de GVHD a fost făcut pe bază clinică și confirmat patologic ori de câte ori este posibil. GVHD acut (aGVHD) a fost clasificat în conformitate cu criteriile CIBMTR. 22 de pacienți ar putea fi evaluați pentru aGVHD după transplant. GVHD cronic (cGVHD) ar putea fi evaluat la pacienții care au supraviețuit> 100 de zile. GVHD cronic a fost clasificat ca limitat sau extins conform criteriilor Sullivan. Cele 23 de criterii de consens NIH nu au fost utilizate în acest studiu deoarece natura lor retrospectivă a limitat datele disponibile pentru clasificarea cGVHD.
Eșecul primar al grefei a fost definit ca absența recuperării neutrofilelor (500500/μl) până în ziua 28 și o biopsie BM cu -5% celularitate. Eșecul secundar al grefei a fost definit ca pierderea ANC la 18
biostatistică
Am comparat rezultatele continue ale utilizării PCA, TPN și LOS între primitorii de palifermină și non-receptori folosind testul t. Pentru a evalua efectul paliferminei asupra fiecăruia dintre aceste rezultate legate de mucozită, modelele de regresie liniară au fost ajustate după ajustarea în funcție de vârstă, utilizarea ATG și regimul de pretratare (bazat pe TBI și chimioterapie). Deși nu se aștepta ca utilizarea ATG să afecteze mucozita, aceasta a fost tradusă în aceste analize multivariate pentru a fi în concordanță cu analizele timpului până la dezvoltarea aGVHD. Analiza riscului competitiv și gestionarea competitivă multivariabilă a controlului regresiei în funcție de vârstă, utilizarea ATG și pretratamentul au fost utilizate pentru a evalua efectul paliferminei la timp până la GVHD acut și cronic. Un test log-rank a fost utilizat pe OS și EFS pentru a evalua efectul paliferminei asupra rezultatelor supraviețuirii. Modelul de regresie Cox a fost aplicat acestor rezultate din timp în eveniment, ajustarea vârstei, utilizarea ATG și modul de pregătire.
Rezultatul
Caracteristicile pacientului
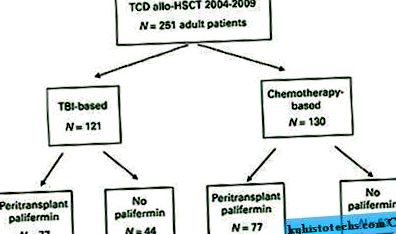
Tabelul 1 descrie în detaliu caracteristicile pacientului. Vârsta medie la transplant a fost de 55 de ani (interval 19-73 ani). Diagnosticele au variat și sunt detaliate în Tabelul 1. Un total de 121 de pacienți au primit condiționare bazată pe TBI (48%, Figura 1). Dintre acești pacienți, 77 (64%) au primit palifermină. Dintre cei 130 de pacienți care au primit alo-HSCT pe bază de chimioterapie (52%), 77 (59%) au primit palifermină. Nouă pacienți au primit BM ca sursă de celule stem, iar restul pacienților au primit grefe PBSC. Un total de 213 pacienți (85%) au primit ATG înainte de perfuzia cu celule stem și doi pacienți au primit ATG după perfuzia cu celule stem. ATG nu a fost administrat la alți 36 de pacienți, toți fiind destinatari de donatori înrudiți și care au fost tratați cu TBI, tiotepa și fludarabină (n = 34) sau TBI, tiotepă și CY (n = 2). 20
Tabel în dimensiune completă
Toți pacienții, cu excepția a doi, au atins niveluri de epuizare a celulelor CD3 +
A ) Incidența cumulativă a aGVHD la toți adulții cu palifermină. b ) Incidența cumulativă a cGVHD la toți adulții cu palifermină.
Imagine la dimensiune completă
OS și EFS
La o supraveghere mediană de 16, 3 luni (interval 0, 03 - 75, 8 luni), SO mediană este de 53 de luni (IC 95%: 32 luni - nerealizată) și EFS mediană este de 39 luni (95% CI: 25 de luni - nu a fost atins). Nu s-a observat niciun efect semnificativ al paliferminei asupra OS (Figura 3a) sau EFS (Figura 3b). Cu toate acestea, vârsta la transplant a fost un factor prognostic semnificativ pentru OS (HR 1, 02, 95% CI: 1, 00-1, 04, P = 0,05) și EFS (HR 1, 02, 95% CI: 1, 00- 1, 04, P = 0, 04), care controlează ATG. regim de utilizare și pregătire.
A ) Sistem de operare atunci când se utilizează palifermin. b ) EFS folosind palifermin.
Imagine la dimensiune completă
discuţie
Rezultatele noastre reprezintă cea mai mare experiență publicată până în prezent cu palifermina la destinatarii alo-HSCT. Datorită limitărilor studiului retrospectiv, inclusiv a unei posibile părtiniri medicale, putem demonstra pentru prima dată că palifermina nu crește toxicitatea legată de transplant într-un mediu de transplant alogen și este eficientă după alo-HSCT bazat pe TBI. Studiile anterioare de evaluare a paliferminei cu alo-HSCT au fost limitate, deoarece aveau dimensiuni mai mici, aveau drept scop prevenirea GVHD și/sau nu foloseau palifermina în regimul de dozare aprobat în prezent. 13, 14, 15
În studiul nostru, 154 de pacienți cărora li s-a făcut alo-HSCT au primit transplant de periaran palifermină. Deoarece acesta a fost un studiu retrospectiv, nu am reușit să raportăm cu acuratețe efectul paliferminei asupra mucozitei de gradul Organizației Mondiale a Sănătății. În afară de studiile prospective concepute special pentru a evalua mucozita, scorul de mucozită înregistrat în diagrama medicală este inconsistent. Au fost utilizate obiectivele clinice legate de mucozită descrise în studiile anterioare 12, 14, 15 și am demonstrat o reducere semnificativă a utilizării TPN, a utilizării PCA și a duratei de ședere. Într-o analiză separată a beneficiarilor alo-HSCT pe bază de TBI și a chimioterapiei, beneficiul paliferminei a fost limitat la pacienții cu TBI. În acest grup de pacienți, palifermina a redus numărul mediu de zile în care pacienții au primit PCA și TPN cu 5 zile (P = 0,033) și TPN cu 4 zile (P 12
Studiul nostru a arătat, de asemenea, că palifermina nu a crescut toxicitatea legată de transplant în timpul allo-HSCT. Nu a fost observată o creștere aparentă a ratelor de aGVHD și cGVHD sau a eșecului grefei la această populație mare de pacienți care au primit o doză de palifermină aprobată de FDA. Cu toate acestea, deoarece toți pacienții au primit alogrefe TCD ex vivo și ATG, este posibil ca palifermina să afecteze dezvoltarea GVHD în alte condiții. Mai mult, nu a existat nicio diferență în OS sau EFS între cele două grupuri (P = 0,74 și P = 0,463).
Există date limitate despre utilizarea paliferminei în timpul transplantului alogen. 13, 14, 15 Blazar și colab. 13 au publicat un studiu randomizat, controlat cu placebo, de fază I/II, care evaluează efectul paliferminei asupra prevenirii aGVHD, pe baza studiilor preclinice care sugerează că palifermina poate preveni aGVHD. 24, 25 Șaizeci și nouă de pacienți au primit palifermină, în timp ce 31 de pacienți au primit placebo. Nu a existat nicio diferență între cele două grupuri în ceea ce privește ratele aGVHD, timpul grefei, recăderea sau supraviețuirea, în concordanță cu datele noastre. Analiza subgrupurilor a relevat o incidență semnificativ redusă și o severitate moderată a mucozitei la pacienții cu CY și TBI, dar nu cu BU și CY. Acest studiu a inclus patru regimuri de dozare diferite, cu opt pacienți care au primit mai puțin și 51 de pacienți care au primit mai multă palifermină decât doza actuală aprobată. Zece pacienți din studiu au primit palifermină la doze concomitente aprobate de FDA.
Langner și colab. 14 prezintă, de asemenea, o serie limitată de palifermine în cadrul allo-HSCT. Aceștia au tratat 30 de pacienți cu palifermin care au suferit alo-HSCT pentru leucemie și i-au comparat cu un grup de control istoric corespunzător. La pacienții cărora li s-a administrat palifermină, incidența mucozitei de gradul II-IV a fost redusă comparativ cu martorii (60% față de 80%, P = 0,04). Pacienții cărora li s-a administrat palifermină (6 vs 12 zile, P = 0,003) au avut, de asemenea, o reducere a mucozitei medii (15 vs 26 de zile, P = 0,002). În acest mic studiu, nu a fost observat niciun efect al paliferminei asupra recuperării hematologice, asupra dezvoltării aGVHD sau OS. În mod similar, Nasilowska-Adamska și colab. 15 au tratat 53 de pacienți transplantați cu palifermină pentru tumori maligne hematologice și i-au comparat cu grupul de control istoric corespunzător. Beneficiul pentru prevenirea mucozitei a fost confirmat și nu a existat nicio diferență între grupuri în dezvoltarea oricărui aGVHD. Alte analize alogene specifice pentru transplant au fost limitate, deoarece doar 24 de pacienți cărora li s-a administrat palifermin li s-a făcut alo-HSCT, în timp ce restul pacienților au primit transplant autolog.
Pe scurt, în acest studiu retrospectiv amplu, demonstrăm că palifermina este eficientă în timpul alo-HSCT și nu crește toxicitatea legată de transplant în acest mediu. Studiul nostru reprezintă cea mai mare cohortă de pacienți tratați cu doza indicată și, prin urmare, aduce o contribuție semnificativă la ghidarea practicii clinice curente cu acest medicament în alo-HSCT. Deoarece utilizarea paliferminei în acest studiu retrospectiv este confundată cu data HSCT și a altor factori clinici, este necesar un studiu prospectiv randomizat pentru a confirma aceste rezultate. În prezent, planificăm un studiu prospectiv mare, multicentric, care să evalueze siguranța și eficacitatea paliferminei la o populație de pacienți cu alo-HSCT TCD mieloablativ bazat pe TBI pentru a confirma constatările noastre.