obiecte
abstract
Boala ficatului gras nealcoolic (NAFLD) este una dintre cele mai frecvente boli ale ficatului, dar mecanismul său de bază este slab înțeles. Aici, am arătat că factorul nuclear al hepatocitelor 4a (HNF4a), un receptor de hormon nuclear îmbogățit în ficat, este inhibat în mod semnificativ, în timp ce miR-34a este puternic indus la pacienții cu steatohepatită nealcoolică, șoareci diabetici și șoareci hrăniți cu un conținut ridicat de grăsimi. dietă. miR-34a este esențială pentru expresia HNF4a și reglează acumularea de trigliceride în hepatocitele umane și de șoareci. miR-34a inhibă secreția de lipoproteine cu densitate foarte mică și promovează steatoza hepatică și hipolipidemia într-un mod dependent de HNF4a. Ca rezultat, creșterea expresiei miR-34a sau scăderea expresiei HNF4a în ficat atenuează dezvoltarea aterosclerozei la șoarecii Apoe -/- sau Ldlr -/-. Aceste date indică faptul că calea miR-34a-HNF4a este activată în condiții normale de stres metabolic și poate juca un rol în patogeneza NAFLD și în reglarea metabolismului lipoproteinelor plasmatice. Concentrarea acestei căi poate reprezenta o nouă abordare a tratamentului NAFLD.
Obezitatea, diabetul și rezistența la insulină sunt factori de risc obișnuiți pentru boala hepatică grasă nealcoolică (NAFLD) 1, 2, 3, una dintre cele mai frecvente boli hepatice la nivel mondial. În Statele Unite, până la 25% din populație are un NAFLD de 4, 5. NAFLD este inițiat de la steatoza simplă, care poate evolua spre steatohepatită nealcoolică (NASH) după multiple „lovituri”, inclusiv mediatori inflamatori, specii reactive de oxigen (ROS) și altele asemenea, 4, 6, 7. NASH poate evolua către ciroză hepatică și carcinom hepatocelular. Până în prezent, mecanismul care stă la baza patogenezei NAFLD este slab înțeles. Tratamentul actual al NAFLD este, prin urmare, limitat la gestionarea sindroamelor asociate, cum ar fi diabetul și obezitatea 8, 9 .
Factorul nuclear 4a al hepatocitelor (HNF4a) este un receptor de hormoni nucleari care joacă un rol important atât în dezvoltare, cât și în fiziologia adulților. Este foarte exprimat în ficat, cu niveluri mai scăzute în rinichi, intestin și celule β pancreatice 10, 11. HNF4a are un domeniu de legare a ADN-ului foarte conservat și un domeniu de legare a ligandului. Analiza structurală a HNF4α sugerează că acizii grași cu lanț lung C14 - C18 sunt strâns legați de capsula hidrofobă a HNF4α și nu pot fi disociați de receptor în condiții non-denaturante 12, 13. Ca atare, HNF4α este activ constitutiv.
HNF4a controlează expresia bazală a multor gene implicate în metabolismul acizilor biliari, lipidelor, glucozei și medicamentelor. Mutațiile în pierderea funcției la HNF4α uman cauzează diabet zaharat de tip 1 (MODY1) cu debut în maturitate, caracterizat prin moștenire autozomală dominantă, diabet cu debut precoce și disfuncție pancreatică a celulelor β14. Fenotipul diabetului pare să fie rezultatul scăderii secreției de insulină stimulată de glucoză în pancreas 15. În plus față de fenotipul diabetului zaharat, pacienții cu MODY1 au redus și trigliceridele plasmatice (TG) și nivelurile de colesterol 16, 17, 18, probabil din cauza secreției afectate a densității foarte scăzute a lipoproteinelor (VLDL) în ficat 19. În concordanță cu scăderea secreției de VLDL, noi și alții am arătat că pierderea HNF4α hepatică duce la ficat gras și hipolipidemie la șoareci 19, 20 .
MicroARN-urile (miARN-urile) sunt molecule mici de ARN necodificatoare care reglează expresia genelor la legarea transcripțională de regiunea 3'-netradusă (3'UTR) a ARNm. MiARN-urile s-au dovedit a fi regulatori importanți ai proliferării celulare, inflamației și metabolismului. Studii recente au arătat că miARN-urile hepatice pot avea un efect semnificativ asupra metabolismului lipidelor și lipoproteinelor 21, 22, 23 .
În acest raport, investigăm rolul căii miR-34a-HNF4α în patogeneza NAFLD umană și în metabolismul lipidelor și lipoproteinelor plasmatice. Datele noastre arată că această cale este activată atât la pacienții cu NASH, cât și la pacienții diabetici sau la șoarecii cu conținut ridicat de grăsimi (HFD). Apoi investigăm dacă și cum această cale reglează metabolismul lipidelor și/sau lipoproteinelor hepatice și plasmatice. În cele din urmă, investigăm ce stimuli metabolici declanșează activarea acestei căi. Datele noastre sugerează că calea miR-34a-HNF4a poate fi o țintă atractivă pentru tratamentul NAFLD uman.
Rezultatul
Reglarea inversă a expresiei HNF4a și miR-34a in vivo
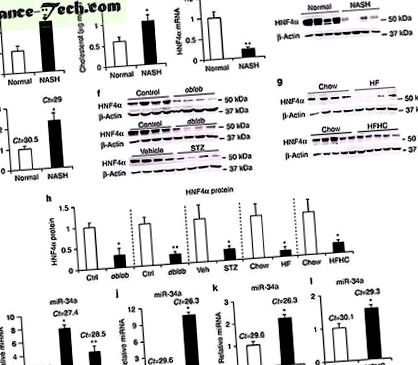
Noi și alții am arătat anterior că pierderea HNF4α hepatică provoacă grăsimi 19, 20 la șoareci. Deoarece HNF4α este extrem de conservat în rândul oamenilor și al rozătoarelor, am investigat rolul HNF4α în dezvoltarea NAFLD umană. În comparație cu subiecții normali, pacienții cu NASH au avut niveluri crescute de TG hepatic (Fig. 1a) și niveluri de colesterol (Fig. 1b). În special, nivelurile de ARNm hepatic HNF4α au fost reduse cu 80% (Fig. 1c), iar nivelurile de proteine HNF4α au fost aproape nedetectabile (Fig. 1d și Figura Adițională 1a) la pacienții cu NASH. În concordanță cu reducerea marcată a expresiei hepatice HNF4α, numărul de gene țintă HNF4α a fost, de asemenea, redus semnificativ la pacienții cu NASH (Tabelul suplimentar 1). MiRNA-urile s-au dovedit a juca un rol în dezvoltarea NAFLD 24, 25. În ficatul pacienților cu NASH, miR-34a (Fig. 1e), dar nu miR-19b sau miR-27b (Figura suplimentară 1b), a fost indusă> de 2 ori.
Pentru a înțelege cum miR-34a reglează expresia HNF4a, am examinat dacă miR-34a se leagă de 3'UTR al HNF4a. Există două site-uri de legare miR-34a foarte conservate atât la 3'UTR HNF4a la om, cât și la șoarece (Figura suplimentară 8a, b). Așa cum se arată în FIG. 3i, mimeticul miR-34a a suprimat în mod semnificativ activitatea promotorului de luciferază legat de Hnf4a3'UTR și această reprimare a fost abolită atunci când al doilea site de legare miR-34a (mutB) a fost mutat. Pentru a confirma datele in vitro, am supraexprimat regiunea codificatoare Hnf4a plus 3'UTR de tip sălbatic sau mutant la șoareci Hnf4a -/- specifici ficatului. Supraexpresia miR-34a a redus semnificativ nivelurile exogene de proteină HNF4a atunci când regiunea codificatoare Hnf4a a fost asociată cu 3’UTR sau 3’UTR de tip sălbatic cu mutații în primul loc de legare pentru miR-34a (mutA), iar această reducere a fost abolită. când regiunea de codare Hnf4a a fost fuzionată la 3 toUTRs cu mutB (Fig. 3j). Astfel, datele noastre in vitro și in vivo indică faptul că miR-34a inhibă expresia Hnf4a prin legarea la al doilea site de legare 3'UTR.
HNF4α reglează aterogeneza și metabolismul energetic
Pierderea mutațiilor funcționale în HNF4α provoacă hipolipidemie la pacienții cu MODY. Nu se știe încă dacă pacienții cu MODY1 protejează împotriva aterosclerozei. Deoarece HNF4α hepatic este semnificativ redus sub diferite stresuri metabolice (Fig. 1), am examinat efectul pierderii acute versus cronice a HNF4α hepatic asupra dezvoltării aterosclerozei. Eliminarea acută a Hnf4a hepatic de către shRNA la șoareci Apoe -/- timp de 3 săptămâni a cauzat o reducere> 50% a nivelului plasmatic total de colesterol și o reducere cu 30% a TG plasmatic în dieta occidentală (Figura suplimentară 9a-c). Analiza profilelor lipoproteinelor plasmatice prin cromatografie lichidă cu proteine flash (FPLC) a arătat că pierderea Hnf4a hepatică a redus colesterolul plasmatic VLDL și LDL colesterol (Fig. 4a) și VLDL TG (Fig. 4b). În concordanță cu modificările lipidelor și lipoproteinelor plasmatice, eliminarea acută a Hnf4α hepatic la șoareci Apoe -/- a redus dimensiunile leziunilor aortice cu> 50% (Fig. 4c și Fig. Suplimentară 9d). În plus, pierderea Hnf4a hepatică la șoareci Apoe -/- a crescut acumularea de TG în ficat (Fig. 4d) și a scăzut expresia proteinei MTP și ApoB (Figura Adițională 9e). Aceste date indică faptul că pierderea acută a HNF4α hepatic reduce dezvoltarea aterosclerozei în Apoe -/- .
MiR-34a hepatică inhibă aterogeneza la Ldlr -/șoareci -
Constatarea că miR-34a reglează metabolismul lipidic prin inhibarea HNF4α (Fig. 3) ne-a determinat să ne întrebăm dacă miR-34a reglează și dezvoltarea aterosclerozei. Supraexprimarea miR-34a la șoarecii Ldlr -/- hrăniți cu o dietă occidentală a redus nivelul colesterolului plasmatic total (Fig. 5a) și nivelurile de TG (Fig. 5b). Datele din analiza FPLC au arătat că miR-34a a redus nivelurile de colesterol VLDL și LDL (Fig. 5c), precum și VLDL TG (Fig. 5d). Ca rezultat, supraexpresia miR-34a în ficat a redus dimensiunea leziunilor aterosclerotice cu> 50% atât în rădăcinile aortice (Fig. 5e, f), cât și în aorta (Fig. 5g, h) ale șoarecilor Ldlr -/-. În ficat, supraexprimarea miR-34a la șoareci Ldlr -/- a inhibat expresia ficatului HNF4a, ApoB100 și ApoB48 (Fig. 5i) și creșterea nivelului de TG în ficat (Figura suplimentară 11). Astfel, fie supraexprimarea miR-34a hepatică (Fig. 5), fie inhibarea HNF4α hepatică (Fig. 4) poate oferi protecție împotriva dezvoltării aterosclerozei.
80%. Ca rezultat, unele dintre genele țintă cunoscute ale Hnf4a sunt, de asemenea, reduse, în timp ce altele rămân neschimbate la acești șoareci (Tabelul 2 suplimentar). Alți factori selectivi pot contribui, de asemenea, la reglarea selectivă a genelor țintă HNF4a la șoarecii hrăniți cu HFD.
Choi și colab. 38 afirmă că miR-34a reduce, de asemenea, nivelurile de NAD + și activitatea SIRT1 prin vizarea NAMPT, o enzimă care limitează rata pentru sinteza NAD +. Deși se știe că SIRT1 joacă un rol important în controlul metabolic, inclusiv metabolismul hepatic al TG, rămâne de stabilit dacă SIRT1 joacă un rol în metabolismul TG reglementat de miR-34a. Conform datelor noastre convingătoare, miR-34a crește nivelul TG în ficat prin inhibarea HNF4a. Interesant este că supraexpresia miR-34a reglează selectiv unele gene țintă HNF4a (Fig. 3), care ar putea fi rezultatul inhibării incomplete a expresiei HNF4a și a reglării genei independente de HNF4a.
O altă constatare importantă a acestui studiu este că demonstrăm că calea miR-34a-HNF4a reglează, de asemenea, metabolismul lipoproteinelor care conțin plasmă ApoB și dezvoltarea aterosclerozei. Se cunoaște că nivelurile plasmatice crescute de lipoproteine care conțin ApoB accelerează dezvoltarea aterosclerozei. Datele noastre indică faptul că calea miR-34a-HNF4a promovează hipolipidemia prin inhibarea secreției VLDL. În concordanță cu această constatare, se pare că pacienții cu NASH au redus secreția de VLDL 39. Datorită hipolipidemiei, fie supraexprimarea miR-34a, fie inhibarea/ablația expresiei hepatice Hnf4a împiedică dezvoltarea aterosclerozei la șoarecii Apoe -/- sau Ldlr -/-. Aceste date furnizează primele dovezi care demonstrează că calea miR-34a-HNF4a reglează dezvoltarea aterosclerozei. Pe baza studiilor noastre, va fi interesant să stabilim dacă pacienții cu NASH și/sau pacienții cu MODY1 sunt protejați de ateroscleroză.
Pe lângă elucidarea rolului căii miR-34a-HNF4α în reglarea metabolismului lipidelor și lipoproteinelor, am investigat și modul în care această cale este activată în stresul metabolic normal. Datele noastre sugerează că calea miR-34a-HNF4a este activată atât în metodele dependente de p53, cât și în cele independente de p53 (Fig. 6j). La pacienții cu NASH, p53, FFA și colesterolul pot coopera pentru a activa calea miR-34a-HNF4a. Cu toate acestea, p53 nu este activat în diabetul sau obezitatea indusă de HFD. Astfel, în aceste din urmă condiții, FFA și colesterolul pot fi factori majori care declanșează activarea căii miR-34a-HNF4a. Una dintre direcțiile noastre viitoare va fi să investigăm modul în care FFA și colesterolul activează calea miR-34a-HNF4α și dacă alți stimuli metabolici sunt implicați în reglarea acestei căi.
Pe scurt, prezentul studiu a arătat că calea metabolică inductibilă de calea miR-34a-HNF4a poate juca un rol critic în patogeneza NAFLD și reglarea metabolismului lipidelor și lipoproteinelor plasmatice. Deși pierderea HNF4α hepatică are un efect benefic asupra aterosclerozei și a homeostaziei energetice, pierderea HNF4α hepatică determină ficatul gras prin inhibarea secreției VLDL. Astfel, din punct de vedere terapeutic, suprimarea expresiei hepatice HNF4α, împreună cu abordări care ameliorează steatoza hepatică, pot fi utile în prevenirea dezvoltării aterosclerozei. În schimb, supraexprimarea HNF4α hepatică nu are un efect major asupra metabolismului lipidelor plasmatice sau lipoproteinelor, deoarece HNF4α este una dintre cele mai abundente gene din ficat 19. Deoarece expresia HNF4α este redusă semnificativ în stresul metabolic (diabet, HFD și hrănirea cu NASH), livrarea de HNF4α prin virusul adeno-asociat sau alți purtători de terapie genetică este o abordare viabilă și atractivă pentru prevenirea și tratamentul NAFLD asociat cu sindromul stresului. Antagonismul funcției hepatice de către antagomirul miR-34a este, de asemenea, o abordare viabilă care poate ajuta la prevenirea dezvoltării NAFLD. Astfel, vizarea căii miR-34a-HNF4a reprezintă o abordare promițătoare și atractivă pentru tratarea NAFLD umană.
metode
Țesuturile umane de ficat, șoarece și dietă
Mutageneză, transfecții și cultură celulară
adenovirusuri
Ad-shLacZ, Ad-HNF4a, Ad-shHNF4a, Ad-goal (control) și Ad-miR-34a au fost descrise anterior 19, 35. Când a fost construit Ad-HNF4a, numai regiunea de codificare Hnf4a (care nu conține 3'UTR) a fost clonată în vectorul adenoviral. În schimb, Ad-HNF4a-3'UTR, Ad-HNF4a-3'UTR_mutA și Ad-HNF4a-3'UTR_mutB au fost create prin clonarea regiunii de codare Hnf4a plus 3'UTR de tip sălbatic sau mutant (cu mutA sau mutB) în vector pAd/CMV/V5-Dest (catalog V493-20, Life Technologies), urmat de transfecție în 293 celule pentru a produce adenovirus 40. Ad-p53 a fost achiziționat de la Vector Biolabs (nr. Cat. 1168). Ad-anti-miR-34a a fost generat folosind Materiale Biologice Aplicate (British Columbia, Canada). Celulele au fost infectate cu adenovirusuri la o multiplicitate de infecție (MOI) de 5. Șoarecii au fost injectați intravenos (iv) cu 0,5 până la 1,5 x 109 pfu de adenovirusuri. Dacă nu se specifică altfel, șoarecii au fost sacrificați la 7 zile după infecție.
PCR în timp real
ARN a fost izolat utilizând reactiv TRIzol (Life Technologies, CA). miARN-urile au fost izolate folosind trusa de izolare mirVana miARN (Life Technologies, CA). Nivelurile de MRNA au fost determinate prin reacție în lanț cantitativă a polimerazei cu transcripție inversă (qRT-PCR) pe o mașină PCR în timp real de 7500 de la Applied Biosystems (Foster City, CA) utilizând SYBR Green Supermix (Roche, Indianapolis, IN). Rezultatele au fost calculate folosind valori Ct și normalizate la niveluri de ARNm 36B4. Nivelurile MiRNA au fost cuantificate folosind primerii și sondele TaqMan (catalog 4427975, Life Technologies, CA) și s-au normalizat la nivelurile U6.
Analizele de microARN ale Northern blot
Nivelurile de microARN au fost, de asemenea, determinate prin teste Northern blot conform instrucțiunilor producătorului (Signosis, Santa Clara, CA. Cat # NB-1001). În analizele Northern blot, rochiile pentru miR-34a (catalog MP-0602) și U6 (catalog MP-0512) au fost, de asemenea, de la Signose.
Analize de activitate MTP
Ficatul a fost omogenizat și activitatea MTP a fost măsurată conform instrucțiunilor producătorului (Chylos, Inc, Woodbury, NY. Cat # R100).
Testele Western blot
Testele Western blot au fost efectuate folosind lizați hepatici întregi 41 sau proteine de bază din probe de ficat și imaginile au fost colectate folosind ImageQuant LAS 4000 (GE Healthcare, Pittsburgh, PA) 42. Anticorpul MTP (catalog sc-135994), anticorpul HNF4a (catalog sc-6556) și anticorpul p53 (catalog sc-6243) au fost cumpărate de la Santa Cruz Biotechnology (Santa Cruz, CA). Anticorpul ApoB a fost achiziționat de la Meridian Life Science (K45253G, TN). Anticorpul β-actină a fost de la Novus Biologicals (catalog NB600-501, CO). Anticorpul histonic a fost de la Cell Signaling (Beverly, MA). Anticorpii au fost folosiți la o concentrație de 1 μg ml-1 .
Antagomirele
MiR-34a LNA inhibitor/antagomir (LNA-miR-34a; anta-miR-34a; anta-34a) și miRNA scramble LNA inhibitor/antagomir (LNA-scr; anta-scr) au fost sintetizate de Exiqon (Danemarca, Cat # 199900 ). șoareci ob/ob sau șoareci hrăniți cu HFD (hrăniți cu o dietă HF timp de 12 săptămâni) au fost injectați intravenos fie cu anta-miR-34a, fie cu anta-scr o dată la 6 zile (10 mg kg-1). După trei injecții, șoarecii au fost sacrificați.
Analiza lipidelor și lipoproteinelor
Aproximativ 100 mg de ficat au fost omogenizate în metanol și lipidele au fost extrase în cloroform/metanol (2: 1 v/v) așa cum s-a descris. Nivelurile trigliceridelor hepatice și ale colesterolului au fost apoi cuantificate folosind reactivi Infinity de la Thermo Scientific (Waltham, MA). Nivelurile plasmatice de lipide și glucoză au fost, de asemenea, determinate folosind reactivi Infinity. Profilul lipoproteinelor plasmatice a fost analizat prin FPLC așa cum este descris în 19. Pe scurt, după injectarea a 100 μl de plasmă, lipoproteinele au fost rulate la 0,5 ml min-1 într-un tampon conținând 0,15 M NaCI, 0,01 M Na 2 HPO 4, 0,1 mM EDTA, pH 7,5 și separate pe un Superose 6 10/300 GL. coloană (GE Healthcare) utilizând sistemul BioLogic DuoFlow QuadTec 10 (Bio-Rad, CA). S-au colectat cinci sute de microlitri de probă pe fracțiune.
Secreția VLDL
Șoarecii C57BL/6J au fost injectați intravenos cu adenovirusuri specifice. În ziua 6, acești șoareci au fost postiti peste noapte, urmată de injecția intravenoasă de Tyloxapol (500 mg kg -1). Sângele a fost prelevat la momentele indicate și s-au determinat nivelurile plasmatice de TG.
Din noua lipogeneză
Șoarecii au fost injectați ip cu apă grea (2 H 2 O) pentru a ajunge la îmbogățire cu 3%. După 4 ore, ficății au fost colectați. Palmitatul marcat și nemarcat, glicerina (trigliceridele) și colesterolul au fost analizate prin spectrometrie de masă 19, 44 .
Leziuni aterosclerotice
Aorta și rădăcina aortică au fost izolate și disecate. Rădăcina aortică a fost spălată cu soluție salină tamponată cu fosfat, încorporată într-un compus de temperatură optimă de tăiere și apoi congelată pe gheață uscată. Criosecțiunile în serie cu grosimea de 7 μm de la porțiunea mijlocie a ventriculului la arcada aortică au fost colectate pe diapozitive superfrost plus microscop (Catalog 12-550-15, Fisher Scientific). În regiunea începând de la supapele aortice, s-a colectat orice altă secțiune. Rădăcina aortică secționată sau aorta în față a fost colorată cu roșu ulei O și dimensiunea leziunii aterosclerotice determinată folosind Image-Pro Premier 9.0 (Media Cybernetics, Rockville, MD) 45 .
Consum de energie
Șoarecii hrăniți cu o dietă occidentală au fost introduși în sistemul de monitorizare completă a animalelor de laborator (CLAMS). S-au determinat consumul de oxigen, producția de CO 2 și producția de căldură 46. Pe scurt, șoarecii au fost introduși în cuști de aclimatizare timp de 40-48 de ore. După perioada de aclimatizare, șoarecii au fost cântăriți și așezați înapoi în cușca de aclimatizare cu alimente pre-cântărite. Schimbul de gaze a fost măsurat la șoareci la fiecare 30 s. Aerul din cameră a fost pompat în cuștile de calorimetrie ale șoarecilor la 0,472-0,600 litri pe minut (LPM), iar aerul din cușcă a fost prelevat la 0,4 LPM. Activitatea fizică a fost măsurată simultan folosind 16 senzori în infraroșu răspândiți pe 19 cm. Datele de la prânz în ziua 1 până la prânz în ziua 2 (EST) au fost selectate pentru analiză.
analize statistice
Semnificația statistică a fost analizată utilizând testul t al Studentului pe două fețe sau ANOVA (GraphPad Prisim, CA). Toate valorile sunt exprimate ca medie ± sem. Diferențele au fost considerate semnificative statistic la P
- Prunc; cu Bye Bye Fat (metabolism normal) 150 g magazin de fitness, nutriție sportivă și suplimente
- Pierderea în greutate METABOLISM bun îmbunătățește ARSURA GRASIMII
- Ierburi împotriva stresului și nervozității Ceaiuri medicinale
- Detoxifiere - Calea către o viață plină
- Batman vs. Joker, excursie pe Marte și LEGO