obiecte
abstract
Osul este reînnoit în mod constant prin înlocuirea osului vechi cu osul nou prin remodelarea osoasă, un proces de transformare constând în interacțiunea și echilibrul dintre celulele care resorbesc osul (osteoclastele) și celulele formatoare de os (osteoblastele) Potențialul dezechilibru între osteoclaste și osteoblaste joacă un rol crucial în patogeneza osteoporozei.
Deficitul de estrogen la femeile aflate în postmenopauză stimulează formarea osteoclastelor, ducând la dezvoltarea osteoporozei postmenopauzale 2, 3. Se estimează că osteoporoza cu deficit de estrogen afectează 40% dintre femeile cu vârsta peste 50 de ani. Printre medicamentele anti-osteoporotice disponibile în prezent, s-a dovedit că terapia de substituție estrogenică postmenopauză are cel mai puternic efect protector împotriva osteoporozei la femei. Din păcate, utilizarea suplimentelor hormonale la femeile aflate în postmenopauză a fost limitată din cauza riscurilor posibile crescute de cancer mamar și endometrial cu utilizare pe termen lung 5. Prin urmare, înțelegerea mecanismelor celulare și moleculare care determină modificările activității celulare asociate remodelării osoase poate identifica ținte terapeutice potențiale pentru osteoporoză și alte patologii legate de os.
Osteoclastele sunt derivate din celule nediferențiate într-o linie monocit-macrofagă. În special, acestea sunt stimulate simultan de două citokine: factorul de stimulare a coloniei de macrofage (M-CSF) și factorul nuclear activator al receptorului ligandului B kappa (RANKL). M-CSF este esențial pentru supraviețuirea și proliferarea precursorilor osteoclastelor, iar RANKL joacă un rol cheie în diferențierea și activarea osteoclastelor 6. Activarea RANKL indusă de RANK pe celulele progenitoare ale osteoclastelor duce la recrutarea factorului de necroză tumorală (TNF) asociat factorului 6 (TRAF6), activând astfel mai multe molecule de semnalizare în aval, cum ar fi NF-κB și protein kinaza activată cu mitogen (MAPK). în stadiu incipient diferențierea osteoclastelor 7. Această cascadă de semnalizare duce la activarea factorilor majori de transcripție, cum ar fi factorul nuclear activat al celulelor T c1 (NFATc1) și c-fos, un membru al factorilor de transcripție 8, 9 ai proteinei activatoare 1 (AP-1) 8, 9, 10 .
Materiale și metode
Reactivi și anticorpi
Alfa mediu esențial minim (α-MEM) și ser bovin fetal (FBS) au fost achiziționate de la Life Technologies (Gibco BRL, Grand Island, NY, SUA). M-CSF de șoarece recombinant a fost achiziționat de la Miltenyi Biotec (Gladbach, Germania). SRANKL de șoarece recombinant a fost obținut de la Prospec Biotec (Ness-Ziona, Israel). SB 203580, SP 600125 și PD 98059 au fost achiziționate de la Enzo Life Sciences (AG, Elveția). 17β-estrogen (E2) a fost obținut de la Sigma-Aldrich (St. Louis, MO, SUA). Antagonistul receptorului de estrogen (ER) ICI 182, 780 a fost achiziționat de la Tocris Bioscience (Bristol, Marea Britanie). Anticorpii împotriva PRMT1, ASYM24, forma regulată sau fosfo a p65, p38, kinază de reglare a semnalului extracelular (ERK) și c-Jun N-terminal kinază (JNK) au fost achiziționați de la Cell Signaling Technology (Danvers, MA, SUA). - actina și catepsina K au fost achiziționate de la Santa Cruz Biotechnology (Santa Cruz, CA, SUA).
Diferențierea osteoclastică și colorarea TRAP
Pentru a genera osteoclaste, celulele măduvei osoase de șoarece au fost izolate de femururile șoarecilor în vârstă de 6-8 săptămâni (Samtako, Gyunggi-Do, Coreea). După liza celulelor roșii din sânge, celulele măduvei osoase rămase au fost incubate la 37 ° C timp de 3 zile în 5% CO 2 în α-MEM suplimentat cu 10% FBS și 1% penicilină/streptomicină în prezența M-CSF (30 ng/ml). Macrofagele derivate din măduva osoasă (BMDM) au fost obținute prin îndepărtarea celulelor plutitoare. Celulele aderente (BMDM) au fost utilizate ca precursori ai osteoclastelor. BMDM-urile au fost cultivate în prezența M-CSF (30 ng/ml) și RANKL (100 ng/ml) timp de încă 3 zile. Formarea osteoclastelor a fost determinată prin colorarea fosfatazei acide rezistente la tartrat (TRAP). După 3 zile, celulele au fost fixate cu soluție fixativă timp de 30 s și colorarea TRAP a fost efectuată utilizând un kit comercial (Sigma, MO, SUA) conform instrucțiunilor producătorului. Numărul de celule multinucleate TRAP-pozitive (MNC, care conțin mai mult de trei nuclee) a fost numărat folosind un microscop cu lumină.
Experimente pe animale
Șoarecii de haploinsuficiență PRMT1 (PRMT1 +/-) pe fundal C57BL/6 au fost furnizați cu amabilitate de Dr. Seung-Hoi Koo (Departamentul de Științe ale Vieții, Universitatea Coreea, Seul, Coreea). Șoarecii de tip sălbatic (WT) (PRMT1 +/+) au fost asociați cu PRMT1 +/- heterozigoți și frații au fost utilizați în experimentele post-genotipare. Toți șoarecii au fost adăpostiți într-o stare specifică fără patogeni, la temperatura camerei de 22 ± 1 ° C cu 50% umiditate. Șoarecii femele șoareci WT (n = 6) și PRMT1 +/- (n = 6) au fost OVX prin îndepărtarea ovarelor bilaterale prin abord dorsal sub anestezie generală cu rompun (10 mg/kg) și zoletil (30 mg)./kg). O operație simulată a fost efectuată în grupul WT (n = 6) prin identificarea ovarelor bilaterale. După 8 săptămâni, toți șoarecii au fost sacrificați și femurele lor au fost îndepărtate pentru tomografie cu microcomputer (μCT). Pentru testul TRAP, oasele au fost fixate în formalină 10% și decalcificate prin imersie în acid etilendiaminetetraacetic 10% (EDTA) timp de 10 zile. Toate studiile pe animale au fost aprobate de Comitetul instituțional pentru îngrijirea și utilizarea animalelor (IACUC) al Universității Naționale din Chonnam (număr de aprobare: CNU IACUC-YB-2016-32).
Western blot
Peletele celulare au fost lizate într-un reactiv de extracție a proteinelor de mamifer (Thermo, IL, SUA) care conține un cocktail inhibitor de protează (Sigma, MO, SUA) și un cocktail inhibitor de fosfatază I + II (Sigma, MO, SUA). Fiecare proteină fracțională a fost extrasă conform instrucțiunilor producătorului. Nivelurile de proteine au fost cuantificate prin metoda Bradford. Extractele de celule întregi (câte 30 μg fiecare) au fost separate prin electroforeză pe gel de poliacrilamidă dodecil sulfat de sodiu (SDS-PAGE) și transferate pe membrane de nitroceluloză amplificate. Membranele au fost apoi spălate cu soluție salină tamponată Tris cu Tween 20 (TBST), blocate cu lapte degresat 5% timp de 1 oră și incubate cu anticorpi primari (la diluțiile recomandate de furnizor) peste noapte la 4 ° C. Membranele au fost apoi spălate cu TBST și incubat cu anticorpi secundari conjugați cu peroxidază de hrean timp de 2 ore la temperatura camerei. Benzile au fost vizualizate folosind un analizor de lumină luminos (ImageQuant LAS 4000, GE Healthcare, Marea Britanie) folosind reactivi Amersham ECL ™ Western Blotting Detgents Reactivi (GE Healthcare, Marea Britanie).
Testele de resorbție osoasă și de colorare a inelului de actină
Pentru testul de resorbție osoasă, BMDM-urile au fost cultivate timp de 4 zile cu M-CSF (30 ng/ml) în prezența sau absența RANKL (100 ng/ml) pe o placă de testare Osteo (Corning Inc., NY). Pentru a cuantifica golurile de resorbție, celulele au fost îndepărtate cu 20% SDS, urmate de o spălare extinsă cu apă distilată și uscare cu aer. Zonele absorbite pe discuri au fost observate la microscop (Eclipse Ni-U, Nikon, Japonia). Pentru a evalua formarea inelului de actină de către celule asemănătoare osteoclastelor, osteoclastele BMDM mature au fost preparate prin tratament cu M-CSF (30 ng/ml) în prezența sau absența RANKL (100 ng/ml) timp de 3 zile pe un pahar de acoperire. celulele au fost fixate și permeabilizate cu 0,2% soluție salină tamponată cu Triton X-100/fosfat (PBS), urmată de colorare cu Alexa Fluor 594-phaloidin (Invitrogen). Celulele au fost apoi placate și nucleele au fost colorate cu 4 ', 6-diamidino-2-fenilindol (DAPI) în mediu de montare ProLong Gold Antifade (Invitrogen, Carlsbad, CA, SUA).
transfecție siARN
Au fost utilizate ARN-uri mici interferente (siARN) pentru PRMT1 (Santa Cruz) și siARN-uri de control (Qiagen) pentru a reduce la tăcere expresia endogenă a PRMT1. Fiecare siARN (50 nM) a fost transfectat în BMDM folosind reactivul LipofectamineTM RNAiMAX (Carlsbad, CA, SUA) după metoda de transfecție directă în conformitate cu instrucțiunile producătorului.
Reacție în lanț în timp real (qPCR)
ARN-ul total a fost extras din celule folosind TRIzol, o soluție monofazică de fenol și izotiocianat de guanidină achiziționat de la Invitrogen (Carlsbad, CA, SUA). Apoi, 1 μg de ARN a fost transcris invers în ADN complementar (ADNc) utilizând sistemul de transcripție inversă RT Premix (AccuPower, Seoul, Coreea) cu primeri oligo-dT18. Apoi, qPCR a fost efectuat folosind ADNc ca șablon cu Power SYBR Green (Applied Biosystems, Warrington, Marea Britanie). Au fost utilizați următorii primeri: PRMT1, 5'-CCTCACATACCGCAACTCCA-3 'și 5'-CATCCAGCACCACCTTGTCT-3'; c-fos, 5'-CCAGTCAAGAGCATCAGCAA-3 'și 5'-AAGTAGTGCAGCCCGGAGTA-3'; NFATc1, 5'-CTCGAAAGACAGTGGAGCAT-3 'și 5'-CGGCTGCCTTCCGTCTCATAG-3'; TRAP, 5'-CTGGAGTGCACGATGCCAGCGACA-3 'și 5'-TCCGTGCTCGGCGATGGACCAGA-3'; catepsina K, 5'-GGCCAACTCAAGAAGAAAAC-3 'și 5'-GTGCTTGCTTCCCTTCTGG-3'; DC STAMP, 5'-CCAAGGAGTCGTCCATGATT-3 'și 5'-GGCTGCTTTGGCCTTTCTC-3'; și β-actină, 5'-AGGCCCAGAGCAAGAGAG-3 'și 5'-TCAACATGATCTGGGTCATC-3'. Datele QPCR au fost normalizate folosind β-actină ca control endogen. PCR în timp real a fost efectuată pe un sistem de PCR în timp real Rotor-Gene Q (Qiagen, Hilden, Germania) utilizând un protocol în doi pași de 95 ° C timp de 10 s, urmat de 40 de cicluri de 60 ° C timp de 60 s.
Imunotest enzimatic (ELISA)
Concentrația de ADMA în supernatantul de cultură a fost măsurată folosind un kit ELISA cu ultrasunete (Eagle Biosciences, Nashua, NH, SUA) conform instrucțiunilor producătorului.
Imunofluorescență și microscopie confocală
Celulele au fost spălate de două ori în PBS și fixate timp de 10 minute cu paraformaldehidă 4% în PBS. După trei spălări în PBS, celulele fixe au fost permeabilizate cu 0,2% Triton X-100 și s-a utilizat o soluție de albumină serică bovină 1% pentru blocare. Celulele au fost incubate cu anticorp PRMT1 (raport de diluție 1: 100) timp de 15 ore la 4 ° C. După trei spălări în PBS, celulele au fost incubate cu anticorp secundar împotriva izotiocianatului de fluoresceină de iepure (FITC) (Sigma, MO, SUA). Celulele au fost apoi așezate pe diapozitive și nucleele au fost vizualizate folosind DAPI. Imagistica prin imunofluorescență a fost efectuată pe un microscop cu scanare laser Leica TCS SP5 AOBS (Leica Microsystems, Heidelberg, Germania) folosind un obiectiv Leica 63 × petrol (NA 1, 4) situat la Centrul Gwangju din Coreea. Excitația (496 și 405 nm) și emisia (500 - 535, 449 - 461 nm) au fost observate pentru constructul conjugat FITC și DAPI. Pentru toate experimentele, timpul de expunere a fost menținut la fel pentru toate probele.
Testul luciferazei
Pentru testul luciferazei, macrofagele Raw 264.7 au fost cotransfectate tranzitoriu cu pGL4.32-luc2P/NF-KB-RE (Promega, WI, SUA) și control sau PRMT1 cu un vector de expresie β-galactozidază pentru a normaliza expresia genei raportor utilizând Lipofectamina 3000 ( Invitrogen, Carlsbad, CA, SUA). La 48 de ore după transfecție, mediul de cultură a fost înlocuit cu mediu care conține RANKL, urmat de incubare timp de 24 de ore. Celulele au fost lizate cu tampon de liză pasiv. Activitatea promotorului a fost măsurată folosind un gândac luciferin și un luminometru GLOMAX. Reactivi pentru măsurarea activității luciferazei au fost cumpărați de la Promega.
Imunoprecipitare
Celulele RAW 264,7 au fost incubate cu sau fără RANKL (100 ng/ml) în prezența M-CSF (30 ng/ml) timp de 24 de ore. Celulele au fost lizate în tampon de liză care nu denaturează compus din 20 mM Tris (pH 7,4), 150 mM NaCI, 1% NP-40, 1 mM EDTA și 5% glicerol. Apoi, 200 µg de proteine au fost incubate cu anticorp PRMT1 și 40 µl de proteină agaroză G în condiții fără denaturare timp de 24 de ore la 4 ° C. Imunoprecipitații au fost spălați extensiv, resuspendați în tampon de probă 2x, fierbeți timp de 7 minute și imunoblotați.
analiza μCT
Un sistem Skyscan 1076 de înaltă rezoluție a fost utilizat pentru a imagina μCT femurilor distali. Imaginile brute au fost reconstruite în imagini cu secțiuni transversale seriale cu praguri identice pentru toate eșantioanele folosind software-ul de reconstrucție a imaginii versiunea 3.1. Un total de 240 de trepte ale oaselor trabeculare ale femurului proximal începând cu 80 de trepte de la placa pineală au fost identificate manual ca zone de interes. Parametrii morfometrici femurali au fost determinați utilizând software-ul de analiză a datelor (CTAn). Morfometria trabeculară a fost caracterizată prin măsurarea volumului osos pe volum de țesut (BV/TV), numărul trabecular (Tb. N), grosimea trabeculară (Tb. Th) și densitatea minerală osoasă (BMD).
analize statistice
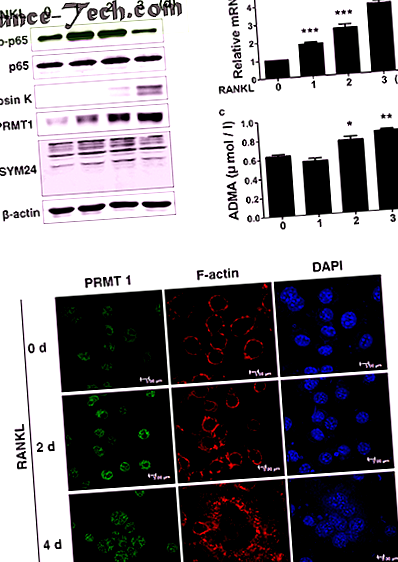
Toate analizele statistice au fost determinate folosind GraphPad Prism 5 (GraphPad, La Jolla, CA, SUA). Valorile statistice au fost calculate folosind testul t Student pentru a compara media celor două grupuri. Analiza unidirecțională a varianței (ANOVA) cu testul post-hoc al lui Tukey a fost utilizată pentru a compara diferențele dintre valorile multiple pentru a evalua diferențele dintre grupurile specifice. Rezultatul a fost considerat semnificativ statistic dacă valoarea P a fost 25, 26. În special, nivelurile de proteine PRMT1 și ADMA au crescut ca răspuns la tratamentul RANKL în timpul diferențierii osteoclastelor (Fig. 1a). Nivelul de expresie al ARNm PRMT1 și concentrația ADMA în supernatantul de cultură au fost, de asemenea, crescute în celulele tratate cu RANKL diferențiate (Fig. Lb, c). Așa cum se arată în FIG. 1d, tratamentul M-CSF și RANKL a indus o formare a inelului F-actină bine definită, care este asociată cu atașarea osteoclastelor la suprafața osoasă și aceasta este însoțită de o creștere a expresiei PRMT1 în nucleu.
anunț BMDM-urile au fost cultivate cu M-CSF (30 ng/ml) și RANKL (100 ng/ml) pentru perioadele de timp indicate pentru a induce diferențierea în osteoclaste mature. Proteinele celulare au fost extrase și Western blotate cu anticorpii indicați. b Rezultate PCR în timp real care arată nivelul de expresie al ARNm PRMT1. Rezultatele au fost normalizate la nivelul expresiei β-actinei. c Nivelul de expresie al ADMA în supernatantul de cultură determinat de ELISA. Rezultatele sunt exprimate ca medie ± SD. * p
Celulele RAW 264.7 au fost transfectate cu control sau PRMT1 siARN conform metodei de transfecție directă. După 24 de ore, celulele au fost transfectate cu plasmide pGL4.32 - luc2P/NF-KB-RE și β-galactozidază. După 24 de ore de transfecție, celulele au fost tratate cu RANKL (100 ng/ml) în prezența M-CSF (30 ng/ml) timp de 24 de ore și apoi lizate cu tampon de liză pasiv pentru un test de luciferază. Activitatea luciferazei a fost măsurată și normalizată la activitatea β-galactozidazei. Datele sunt prezentate ca medie ± SD. *** p +/-. La opt săptămâni după OVX, s-au efectuat analize histomorfometrice și μCT pe osul trabecular al femurului distal. Secțiunea de parafină histomorfologică sagitală a femurului a fost supusă colorării TRAP. Activitatea osteoclastică a fost semnificativ crescută în metafiza șoarecilor WT OVX, dar nu la șoarecii PRMT1 +/- OVX (Fig. 6a). Analiza morfometrică a micro-CT a arătat că OVX a condus la o reducere marcată a BMD, BV/TV, Tb. N și Tb. Th la șoareci WT (Fig. 6b, c). Cu toate acestea, astfel de reduceri au fost inversate la șoarecii PRMT1 +/- OVX (Figurile 6b, c). Aceste rezultate indică faptul că deficitul de PRMT1 poate proteja șoarecii de pierderea osoasă indusă de OVX.
Colorarea TRAP a femurului distal a fost efectuată folosind truse de fosfatază acidă leucocitară și observată la microscop (săgeată). b Sunt prezentate imagini bidimensionale reprezentative ale femurilor. c Volumul osos pe volum de țesut (BV/TV), numărul trabecular (Tb. N), grosimea tubului trabecular (Tb. Th) și densitatea minerală osoasă (BMD) au fost determinate din măsurători μCT (n = 6). * Șoarecii p +/- OVX suprimă activitatea osteoclastelor și pierderea osoasă și că stimularea E2 este suficientă pentru a bloca diferențierea osteoclastelor RANKL 30, am investigat în continuare dacă expresia PRMT1 ar putea fi afectată de 17β-estrogen (E2) în timpul diferențierii osteoclastelor in vitro. BMDM-urile au fost pretratate cu E2 și ulterior tratate cu proteină RANKL și PRMT1 și s-au determinat nivelurile de ARNm PRMT1. Rezultatele au arătat că expresia genică mediată de RANKL și nivelul de exprimare a proteinei PRMT1 au fost suprimate prin tratamentul E2 în BMDM (Fig. 7a, b). În plus, ICI 182, 780, un antagonist al ER, a abolit efectul inhibitor al E2 asupra expresiei PRMT1 (Fig. 7c, d). Aceste descoperiri sugerează că E2 poate avea un efect protector împotriva osteoporozei prin reducerea expresiei PRMT1.
A, b BMDM-urile au fost pretratate cu sau fără E2 (1 μM) timp de 2 ore și apoi tratate cu RANKL (100 ng/ml) timp de 24 de ore. Expresia proteinei PRMT1 a fost examinată prin Western blot. b Nivelul de ARNm PRMT1 a fost măsurat prin PCR în timp real și apoi normalizat la nivelul β-actinei. c, BMDM-urile au fost pretratate cu E2 (1 μM) cu sau fără pretratare cu ICI 182, 780 (10 μM). După 2 ore, celulele au fost tratate cu RANKL (100 ng/ml) timp de 24 de ore. Proteinele au fost extrase și supuse analizei Western blot cu anticorpi PRMT1 și β-actină. Datele sunt prezentate ca medie ± SD. * p +/-) șoareci și aceste rezultate sugerează că PRMT1 poate contribui la diferențierea osteoclastelor și la osteoporoză.
Studiile anterioare au furnizat dovezi că ADMA, un produs PRMT tip 1, poate fi implicat în dezvoltarea osteoporozei. Kanazawa și colab. raportează că la pacienții cu diabet zaharat, nivelurile serice de dimetilarginină sunt asociate cu prezența fracturilor vertebrale 31. Lu și colab. a demonstrat că o creștere a nivelurilor serice de ADMA este asociată cu o scădere legată de vârstă a BMD32 la șobolani. În acest studiu, am constatat că nivelurile ADMA au crescut în mediul de cultură celulară în timpul diferențierii osteoclastelor induse de RANKL. Deși mai multe studii au raportat că ADMA este asociată cu diferite boli metabolice 33, 34, sunt necesare studii suplimentare pentru a releva rolul exact al ADMA ca factor de risc în diferențierea osteoclastelor și osteoporoza. În plus, acestea ar trebui să clarifice semnificația clinică a nivelurilor ADMA la pacienții cu osteoporoză.
În cele din urmă, rezultatele noastre au arătat că expresia PRMT1 a fost crescută în nucleul BMDM tratat cu RDMKL printr-o cale de semnalizare mediată de JNK (Fig. 7e). PRMT1 a fost esențială pentru activitatea osteoclastelor induse de RANKL, resorbția osoasă și reglarea genelor legate de osteoclastogeneză. În plus, deficitul de PRMT1 a redus activitatea osteoclastică in vivo și pierderea osoasă la șoarecii OVX. Astfel, PRMT1 poate fi o țintă terapeutică pentru tratamentul dezvoltării și progresiei osteoporozei.
Mulțumiri
Acest studiu a fost susținut de un grant (2017R1D1A1A02019106) de la Fundația Națională de Cercetare (NRF), finanțat de guvernul coreean.
- Endometrioza contribuie la atractivitatea femeilor Unilabs
- Ștergerea specifică a traf3 în limfocitele b duce la dezvoltarea limfomului b la șoareci - leucemie
- Compania de asigurări de sănătate contribuie la o dietă fără gluten Dacă da, pentru care; Întâlnire economică
- Vă confruntați cu performanțe scăzute și oboseală Viața dvs. poate fi în pericol
- PELION - Ungaria - Tapolca - cel mai mic preț de la 0 € - HELLAS TRAVEL