- obiecte
- abstract
- introducere
- Represia genei la nivel cromozomial și modificarea epigenetică a Xi
- Mecanismul de tăcere a genelor necodificatoare Xist ARN
- Reglarea procesului de inactivare X
- Conservarea și divergența inactivării X la mamifere
- Concluzii pentru mecanismul de inactivare X
obiecte
- Compensarea dozei
- Epigenetica
- Reglarea genelor
abstract
Mamiferele inactivează unul dintre cei doi cromozomi X de sex feminin pentru a compensa numărul inegal al copiilor genetice legate de X între bărbați și femele. Acest proces de inactivare X are ca rezultat mutarea unui cromozom X într-o manieră reglementată de dezvoltare. În această lucrare, vom examina descoperirile recente privind inactivarea X și vom discuta despre modul în care aceste progrese îmbunătățesc înțelegerea mecanică. Ultimele rezultate oferă o perspectivă asupra modului în care o celulă numără și selectează un număr adecvat de cromozomi X pentru inactivare, cum ar fi reprimarea genetică coordonată pe tot parcursul cromozomului și modul în care se formează un cromozom X inactiv stabil. Componentele cheie ale acestui sistem complex de reglementare au fost deja identificate și oferă puncte de intrare pentru înțelegerea reglării epigenetice la mamifere. Majoritatea datelor au fost obținute dintr-un studiu efectuat la șoarece. În prezent nu este clar cât de general pot fi aplicate aceste descoperiri altor specii de mamifere. Încercăm să evaluăm acest aspect din datele care au devenit disponibile.
La șoareci, ARN-ul Xist se formează deasupra cromatinei non-genetice a nucleului regiunii cromozomului X (Chaumeil și colab., 2006). Chiar și la Xi XIST uman, regiunea centrală a regiunii cromozomiale, care conține în mare parte repetiții genomice, pare să se suprapună (Clemson și colab., 2006). Acest lucru sugerează că obiectivele principale ale Xist nu sunt gene, ci secvențe în regiunile non-genetice ale cromozomului X. La Xi, genele sunt situate la marginea domeniului Xist, indiferent dacă sunt reduse sau nu (Clemson și colab., 2006). Situația de pe Xi este dificilă. Multe gene ale Xi umane și mai multe gene ale Xi murin scapă de silențiere genetică și sunt exprimate din Xi și cromozomul X activ (Xa). Ceea ce determină dacă o genă este redusă la tăcere sau rămâne activă pe Xi nu este pe deplin clar. Rezultate recente indică faptul că cel puțin una dintre genele de evacuare la șoareci, Jarid1c, conține elemente care determină starea activă a acesteia independent de poziția sa cromozomială pe Xi (Li și Carrel, 2008). Acest lucru sugerează că secvențele cromozomiale sau proprietățile locusului genei modulează efectul pe care Xist îl exercită asupra expresiei. De asemenea, nu se știe cum Xist reprimă genele din siturile primare de legare non-genetice, deși s-au obținut dovezi ale compartimentării nucleare (Heard și Bickmore, 2007; Chow și Heard, 2009).
Represia genei la nivel cromozomial și modificarea epigenetică a Xi
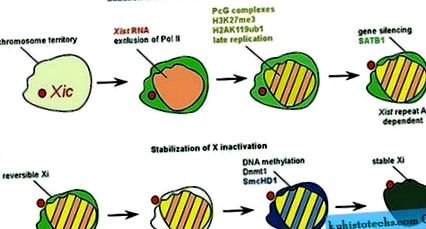
În celulele somatice feminine, Xi formează o structură heterocromatică stabilă și poate fi vizualizat prin diferite tehnici de colorare. Reactivarea genetică pe Xi heterocromatică poate fi dificil de realizat, cu excepția cazului în care schimbările în soarta celulelor sunt declanșate în timpul reprogramării la tipul embrionar timpuriu (Takagi și colab., 1983). Reactivarea X inactiv a fost observată în timpul generării de celule stem pluripotente induse de la celule somatice femele de șoarece (Maherali și colab., 2007). Încercările de a bloca căile epigenetice definite în celulele somatice, inclusiv dezacetilarea histonelor și metilarea ADN, au realizat reactivarea parțială a Xi într-un număr mic de celule (Csankovszki și colab., 2001). Acest lucru a condus la concluzia că reducerea la tăcere a genelor de pe Xi este mediată de o serie de factori epigenetici care lucrează împreună pentru a menține starea inactivă a cromozomului. Xi suferă mai multe modificări și este îmbogățit cu factori care au fost asociați cu cromatina silențioasă (Figura 1). Un astfel de factor este varianta histonică macroH2A, care este distribuită aproape uniform în Xi în celulele somatice (Mietton și colab., 2009). Acest lucru ar putea sugera că odată realizată o inactivare stabilă, genele și secvențele non-genetice sunt acoperite de modificări epigenetice similare cu Xi.
Imagine la dimensiune completă
Compoziția cromatinică a Xi diferă semnificativ de cea a altor cromozomi din celulele somatice. Xi este îmbogățit în mai multe modificări ale histonelor, cum ar fi metilarea histonei H3 a lizinei 27 și ubiquitinarea histonei H2A (Plath și colab., 2003; de Napoles și colab., 2004; Fang și colab., 2004). Acest lucru este în paralel cu recrutarea complexelor Polycomb (Figura 1a), care s-au dovedit a cataliza aceste modificări ale histonelor (Plath și colab., 2004). Mai mult, histona H4 este hipoacetilată și di- și tri-metilarea histonei H3 de lizină 4 este puternic redusă la Xi (Chaumeil și colab., 2002). Aceste modificări ale histonelor s-au corelat în general cu expresia genelor, iar reducerea acestor modificări ale cromatinei la Xi ar putea fi interpretată ca o consecință a inactivității sale transcripționale. Funcțiile proteinelor Polycomb și modificările histonice, precum și ale altor componente Xi, care includ varianta histonei macroH2A, precum și proteina nucleară a schelelor SAF-A (Fackelmayer, 2005), trebuie să fie caracterizate. Opinia actuală este că mai mulți markeri de cromatină contribuie la menținerea represiunii asupra Xi (Csankovszki și colab., 2001; Hernandez-Munoz și colab., 2005).
Mecanismul de tăcere a genelor ARN non-Xist
Inactivarea X este inițiată în mod normal în timpul embriogenezei timpurii la șoareci. Conversia substanței active în cromozomul X silențios transcripțional este observată, de asemenea, în diferențierea celulelor stem embrionare de șoarece. Acesta oferă un sistem puternic de cultură celulară pentru studierea mecanismului de reducere a zgomotului în cromozom (Payer și Lee, 2008). Inactivarea X este indusă de acumularea de ARN Xist în viitorul Xi. O secvență conservată la 5 'Xist, numită repetare A, este necesară pentru a reduce la tăcere genele (Wutz și colab., 2002). Exprimarea Xist fără repetarea A nu provoacă reprimarea genelor, dar duce la localizarea Xist și recrutarea majorității modificărilor cromatinei la Xi (Chaumeil și colab., 2006). Se crede că motivul ARN care se repetă se asamblează într-o structură de buclă a tulpinii care ar putea funcționa ca un loc de legare pentru factorii de tăcere (Wutz și colab., 2002). Recent, structura repetării ARN-ului A a fost, de asemenea, investigată experimental (Duszczyk și colab., 2008). Acest studiu a confirmat prima buclă stem cu descoperirea suplimentară că motivul ARN-ului ar putea fi dimerizat printr-o secvență proiectată anterior pentru a forma a doua buclă. Ștergerea repetării A la șoareci a dezvăluit, de asemenea, o funcție pentru reprimarea genei antisens Tsix din Xi, sugerând funcții suplimentare pentru regiunea de repetare A în reglarea inactivării X (Hoki și colab., 2009).
Represiunea Xistu a unei gene pe tot parcursul cromozomului este limitată la anumite tipuri de celule. În mod normal, inactivarea X este inițiată în celulele embrionare timpurii. În plus, s-a dovedit că progenitori specifici din sistemul sanguin au un context celular adecvat pentru a iniția mutarea (Savarese și colab., 2006). Acest lucru a fost demonstrat prin experimente folosind un sistem de expresie inductibil pentru a activa Xist la șoareci masculi. Expresia XIST poate provoca, de asemenea, reprimarea genelor în unele linii de celule somatice umane cu grade diferite de modificare a cromatinei (Chow et al., 2007). Recent s-a demonstrat că Xist poate iniția mutarea cromozomilor în celulele tumorale derivate din limfomul murin (Agrelo și colab., 2009). Această constatare ridică întrebarea dacă căile epigenetice active în mod normal în timpul inactivării X în embrion pot fi accesibile celulelor tumorale și dacă aceste căi contribuie la tumorigeneză.
Reglarea procesului de inactivare X
Reglarea inactivării X. A ) Inactivarea este inițiată într-o manieră controlată de dezvoltare. Toți cromozomii, cu excepția unuia X, sunt inactivați în celula diploidă. În prezent, opinia este că acest lucru se realizează prin reglarea expresiei lui Xist. Elementele pentru reglarea Xist formează regiunea Xic. La începutul inactivării X, se crede că împerecherea transcromozomială a regiunilor Xic declanșează expresia Xist a unui singur cromozom X. Acest lucru duce la reducerea la tăcere a genelor de-a lungul cromozomului și la formarea Xi. ( b ) Elementele care reglementează expresia Xist în Xic includ transcrierea necodificatoare Tsix (verde). Tsix este transcris într-o orientare antisens și suprapune unitatea de transcriere Xist și reprimă expresia Xist. În cadrul Xic, au fost identificate mai multe site-uri de legare Oct4 (cercuri roșii) și mediază represiunea Xist în modurile dependente de Tsix și independente de Tsix. CTCF este, de asemenea, implicat în expresia Tsix și în asocierea Xic .
Imagine la dimensiune completă
La șoareci, expresia Xist este reprimată de ARN Tsix antisens (Figura 2b). Unitatea de transcriere Tsix se suprapune peste Xist, creând o pereche antisens. Această asociere antisens Xist-Tsix a dat naștere la ideea unei posibile implicări a ARN-ului cu două fire, pe care Dicer ar putea să o proceseze în ARN-uri mici. Într-adevăr, aceste mici ARN-uri au fost găsite într-un studiu recent (Ogawa și colab., 2008). Cu toate acestea, o analiză cuprinzătoare a celulelor stem embrionare a arătat că ștergerea Dicer are un efect redus asupra procesului de inactivare X, sugerând că Dicer nu joacă un rol semnificativ în reglarea inactivării X (Kanellopoulou și colab., 2009). Ștergerea Dicerei pare să deregleze procesarea microARN-urilor endogene, ducând la pierderea metilării ADN-ului și afectând astfel și inactivarea X (Nesterova și colab., 2008). Aceste date sunt în concordanță cu efectele indirecte ale Dicer asupra inactivării X, iar problema ARN-ului cu dublă catenă în inactivarea X lasă deschise investigații suplimentare.
Factorul de transcripție a celulelor stem Oct4 a fost implicat recent în reglarea expresiei Xist la șoareci (Navarro și colab., 2008; Donohoe și colab., 2009). S-a arătat că Oct4 leagă secvențele de ADN în cadrul intronului Xist 1 și în jurul secvențelor de promotor și amplificator Tsix (Figura 2b). S-a raportat că Oct4 mediază represiunea Xist în regimurile dependente de Tsix și independente de Tsix. Astfel, expresia Oct4 ar putea limita reglarea ascendentă a Xista până la debutul inactivării X. Cu toate acestea, Oct4 este exprimat și la niveluri ridicate împreună cu Xista în linii celulare, altele decât celulele stem embrionare de șoarece, inclusiv celulele stem derivate din epiblasti de șoarece (Navarro și Avner, 2009). Prin urmare, este puțin probabil ca expresia Oct4 să fie singurul factor determinant al reglementării Xista și un alt strat de control ar putea aștepta descoperirea.
Conservarea și divergența inactivării X la mamifere
Concluzii pentru mecanismul de inactivare X
Inactivarea X accidentală s-a dezvoltat exclusiv la mamiferele placentare. Acest lucru sugerează că sistemul de compensare a dozei se bazează pe procese care mediază reglarea genelor într-o măsură mai mare la vertebrate. O excepție notabilă este secvențele de reglare Xist RNA și Xic necodificate. Acestea au fost special dezvoltate pentru a compensa doza. Există, de asemenea, dovezi că dezvoltarea elementelor de reglementare nu sa oprit și ar putea avea loc chiar și la mamiferele actuale. Reglarea inactivării X include asocierea cromozomială și reprimarea antisens. Complexele Tsix, CTCF, Oct4 și Polycomb au fost implicate ca actori moleculari în acest proces. Tăcerea în tot cromozomul este indusă de ARN-ul Xist necodificator și pare a fi un proces în mai multe etape. Xist și SATB1 acționează pentru a iniția silențierea genelor, iar SmcHD1 și metilarea ADN joacă un rol crucial în menținerea represiunii Xi. Complexele din policomb sunt implicate în reducerea la zgomot a întregului cromozom X, dar funcția lor exactă trebuie investigată.
Obiectivele lui Xist pe cromozom rămân necunoscute. Mai multe studii au sugerat rolul repetărilor genomice și al ADN-ului non-genetic în inactivarea X. Genele și cromatina non-genetică sunt separate spațial pe Xi. Observația conform căreia Xist se suprapune peste centrul bogat repetat al regiunii cromozomiale X sugerează că cromatina non-genetică ar putea fi ținta principală a Xist. Acest lucru deschide ideea că inactivarea X ar putea coopta mecanismul deja existent de estompare repetată a elementelor. Repetările genomice includ reziduuri de elemente genetice mobile care au invadat genomul și ulterior au fost inactivate. Aceasta include dezvoltarea mecanismelor de apărare a gazdei. Poate fi un X inactiv rezultatul implicării controlate a strategiilor de apărare a gazdei care este indusă de expresia Xista? S-a sugerat că elementele cu repetări îndelungate împrăștiate (LINE) îndeplinesc o funcție în propagarea inactivării X. Recent, inactivarea X a fost comparată la mamifere în care proliferarea LINE a încetat. Aceste date indică faptul că amplificarea LINE nu este neapărat necesară pentru inactivarea X, sugerând că alte tipuri de elemente ar putea juca un rol similar în inactivarea X (Cantrell și colab., 2009).
Progresele în înțelegerea inactivării X au ridicat întrebări noi și mai clare. Este necesar să se identifice factorii care mediază interacțiunile trans-cromozomiale în timpul împerecherii Xic-Xic la începutul inactivării X. celule. Un element cheie care lipsește în înțelegerea căii de reducere a genei este legătura dintre repetarea SATB1 și Xist A. Răspunsul la aceste întrebări nu numai că va avansa în înțelegerea compensației dozei la mamifere, dar va oferi, de asemenea, o perspectivă asupra proceselor nucleare de bază ale reglării epigenetice a mamiferelor.
- Laura Markham 8 reguli care ajută la educația copiilor de 10-12 ani
- Ce cizme de cauciuc să alegi pentru un bebeluș New Time
- Michalovce - Portalul serviciilor electronice Elektronické služby Oferirea de beneficii unice în
- Grupuri sanguine, ereditate și imunitate - Pământ; Vârstă
- Carnea pe care o mâncăm cu adevărat