obiecte
abstract
Studiile anterioare au arătat că mulți factori de mediu nefavorabili în timpul vieții prenatale pot afecta dezvoltarea bolilor adulte (de exemplu, hipertensiune arterială, diabet zaharat și așa mai departe). 1, 2, 3 Un număr de insulte prenatale (de exemplu, nicotină, hipoxie, dietă săracă în proteine etc.) pot „programa” anumite probleme cardiovasculare și pot crește susceptibilitatea la boli cardiovasculare la o vârstă mai târzie. 3, 4, 5, 6 Consumul excesiv de zaharoză în timpul sarcinii s-a dovedit a duce la obezitate și intoleranță la glucoză la pui, precum și la hipertensiune la ambele sexe 1 și poate fi asociat cu rezistența la insulină și hiperglicemie la șobolani. O dietă prenatală bogată în zaharoză (HS) poate fi, de asemenea, responsabilă pentru o serie de efecte adverse asupra dezvoltării fetale. Cu toate acestea, mecanismele care stau la baza care contribuie la dezvoltarea hipertensiunii arteriale la descendenții expuși la un nivel ridicat de zahăr utero nu sunt clare.
Când s-a administrat șobolanilor în timpul sarcinii, sa demonstrat că captoprilul, un inhibitor al enzimei de conversie a angiotensinei, previne dezvoltarea hipertensiunii arteriale programată de o dietă maternă cu conținut scăzut de proteine, sugerând un rol cheie pentru sistemul renină-angiotensină (RAS) în dezvoltare. hipertensiune. În plus, un antagonist specific al receptorului AT1 (AT1R), losartanul, ar putea elimina creșterea tensiunii arteriale (TA) care rezultă din expunerea maternă cu proteine scăzute la șobolani, sugerând că angiotensina II (Ang II), un hormon critic în reglare de homeostazie cardiovasculară., joacă un rol important în programarea prenatală a hipertensiunii. În acest studiu, am examinat presiunea BP și Ang II care răspund la descendenții expuși la zahăr prenatal ridicat.
Ang II poate stimula vasoconstricția în trei moduri principale: prin eliberarea de Ca 2+ din depozitele intracelulare, prin fluxul transmembranar de Ca 2+ predominant prin canalele de Ca 2+ de tip L (Ca în 1.2) și prin activarea uneia sau mai multor protein kinază C ( PKC) izoforme. S-a demonstrat că PKC crește Ca2 + intracelular prin activarea Ca în 1, 2, care la rândul său induce vasoconstricție. Studiul nostru anterior a arătat că consumul excesiv de zahăr în timpul sarcinii a dus la un răspuns vascular crescut la Ang II. 12 White și colab. 13 a arătat că sensibilitatea crescută a arterelor mezenterice de la șobolanii streptozotocin-diabetici la agoniștii alfa-adrenergici este mai dependentă de calciu extracelular. Alte laboratoare au arătat că celulele mușchiului neted aortic dintr-un model de șoarece cu diabet de tip 1 arată o creștere a curentului de Ca în 1, 2. Prin urmare, acest studiu a fost conceput pentru a testa dacă calea PKC/Cao 1.2 contribuie la creșterea Ang II- răspuns de presiune mediat și vasoconstricție în descendenții HS.
metode
Șobolanii Sprague-Dawley însărcinați de la Soochowski University Animal Center au fost adăpostiți într-un mediu controlat la 22 ° C cu un ciclu de lumină/întuneric de 12 ore. Aceștia au fost împărțiți în mod aleatoriu în două grupuri: (1) grupul de control a fost alimentat cu o dietă standard și (2) grupul HS a primit aceeași mâncare și soluție de zaharoză 20% din ziua 1 a sarcinii. apă de la robinet și mâncare standard pentru șobolani timp de 5 luni. Toate procedurile au fost aprobate de Comitetul instituțional pentru îngrijirea animalelor și au fost în conformitate cu Manualul pentru îngrijirea și utilizarea animalelor de laborator.
Măsurarea glicemiei și a greutății corporale
Șobolanii gravide (în ziua 21 de gestație), precum și descendenții masculi adulți la vârsta de 5 luni au fost anesteziați cu un amestec de ketamină (75 mg kg-1) și xilazină (10 mg kg-1; Medicina Hengrui, Jiangsu, China) administrat intraperitoneal. Probele de sânge fetal au fost prelevate după decapitare. Probele de sânge de la mamă și descendenți au fost obținute din aorta abdominală. Probele de sânge au fost prelevate în tuburi de plastic răcite cu gheață care conțin heparină. Glicemia a fost determinată folosind un analizor Nova (Nova Biomedical, Waltham, MA, SUA) și s-a măsurat greutatea corporală.
Măsurarea TA
Puii au fost implantați în arterele lor femurale cu un cateter pentru a înregistra TA, așa cum este descris. După 3 zile de recuperare după operație, TA a fost măsurată continuu la șobolani conștienți și în mișcare liberă. După înregistrarea de bază în timpul
Ang II (100 ng kg-1; Sigma, St. Louis, CA, SUA) 16 în 0,2 ml de soluție salină a fost injectat intravenos prin cateter timp de 60 de minute și BP a fost înregistrată pentru încă 120 de minute folosind un dispozitiv Power. -Sistem de lucru și software (AD Instruments, Bella Vista, New South Wales, Australia).
Măsurarea tonusului vascular
Segmente mici de artere mezenterice (ramura de ordinul patru) au fost izolate în soluția Krebs-Henseleit (mmol -1: NaCl 115, NaHCO 3 25, KCl 4, 6, NaH 2 PO 4 1, 2, MgCl 2 1, 2, CaCl 2 2, 5 și glucoză 10). pH 7, 4 și montat într-un sistem multimiografic (Danish Myo Technology, Iutlanda Centrală, Danemarca), menținut în soluție oxigenată Krebs-Henseleit (95% O 2, 5% CO 2) la 37 ° C. 17, 18 După echilibrare pentru 60 de minute, inelele vasculare s-au contractat cu concentrații crescând cumulativ de Ang II (10-11-10-5 mol-1). Losartan (antagonist AT1R, 10 μmol l -1), 19 PD123319 (antagonist AT2R, 10 μmol l -1), 19 GF109203X (antagonist PKC, 1 μmol l -1) 20 sau nifedipină (antagonist Cav 1, 2, 10 μmol l ) - 1) 21 au fost folosite pentru tratarea prealabilă a segmentelor timp de 30 de minute înainte de aplicarea Ang II. Curbele cumulative concentrație-răspuns ale activatorului PKC, forbol 12, 13-dibutirat (PDBu, 10 - 9 - 10 - 5 l - 1) sau KCl (20 - 140 mmol l - 1) au fost efectuate atât în absența, cât și în prezența nifedipinei în arterele mezenterice. Tonul vasului a fost normalizat de contracția maximă indusă de 60 mmol-1 KCl sau de răspunsul maxim al vasului la un agonist specific. Fiecare container a fost folosit o singură dată. Semnalele au fost înregistrate folosind un sistem Power-Lab cu software Chart 5 (AD Instruments, Castle Hill, NSW, Australia).
Izolarea miocitelor vasculare
Miocitele au fost izolate enzimatic din arterele mezenterice separate. 22 Recipiente au fost tăiate în benzi de 1 mm în soluție rece ca gheața (PSS) conținând (mmol-1) 137 NaCI, 5,6 KCl, 1 MgCl 2, 0,42 Na 2 HPO 4, 0,44 NaH 2 PO 4, 4,2 NaHCO 3 și 10 HEPES (pH 7, 4). Toate soluțiile enzimatice conțineau 1 mg ml-1 ser albumină bovină. Celulele musculare netede vasculare izolate au fost obținute prin triturare ușoară în PSS. Celulele au fost depozitate la 4 ° C pentru studiu timp de 6 ore.
Măsurarea electrofiziologică
Miocitele au fost plasate direct pe fundul camerei experimentale și vizualizate folosind un microscop inversat (OLYMPUS CKX41, Tokyo, Japonia). Celulele au fost spălate cu soluție de baie pentru a îndepărta impuritățile. Pipetele de patch-uri au fost extrase din capilare de sticlă cu pereți subțiri folosind un stripper de micropipete (Model P-30, Sutter Instruments, Novato, CA, SUA). Rezistența vârfului pipetei patch-uri a fost de 3 x 4 MΩ când a fost umplută cu soluția interioară a pipetei.
Clema de tensiune pentru întreaga celulă a fost realizată folosind un sistem de prindere de curent și tensiune controlat de computer (Multiclamp 700B, Digidata 1440, Axon Instruments, Foster City, CA, SUA) alimentat de Clampex 10.1 și Multiclamp Commander 1. Pipetă offset și sistem de celule întregi capacitatea a fost compensată electronic. Potențialul membranei celulare a fost măsurat în modul gapless în configurația de curent-clemă a întregii celule și întregul curent de celulă a fost măsurat în modul de stimulare episodică în configurația clemei de tensiune a întregii celule utilizând un amplificator Axonpatch 700B și Clampex 10.1. curenții celulari au fost normalizați cu capacitatea celulei pentru a obține densitatea curentului.
Analiza Western blot
Prezența proteinelor subunității c PKC α, δ și Cav 1.2 α1 în arterele mezenterice a fost măsurată prin analiza Western blot normalizată la β-actină. 23, 24 Anticorpii primari au fost anticorpi policlonali de capră (Santa Cruz Biotechnology, Santa Cruz, CA, SUA) împotriva subunităților Ca în 1,2 și 1 subunități c (1: 200), anticorp policlonal de iepure (Santa Cruz Biotechnology) împotriva PKCa (1: 200) sau PKCδ (1: 200). Anticorpul secundar a fost anticorpul anti-capră de măgar (1: 4.000) sau anticorpul de capră anti-iepure (1: 4.000; Beyotime Biotechnology, Jiangsu, China). Imunosemnalele au fost vizualizate folosind detectarea chemiluminiscenței (Amersham Biosciences, Piscataway, NJ, SUA) și un sistem de imagistică UVP (EC3-Imaging-System, Upland, CA, SUA). Semnalele de imagistică au fost digitalizate și analizate, iar apoi s-a obținut raportul de intensitate a benzii de β-actină pentru a cuantifica nivelul expresiei relative a proteinelor.
Analiză și statistici
Datele au fost exprimate ca semnal mediu ± sem 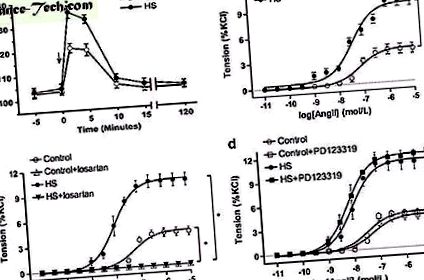
( A ) Răspunsurile de presiune mediate de Ang II la descendenți. Săgeată: timpul de injectare intravenos Ang II. Control (n = 10 din cinci baraje), HS: zaharoză mare (n = 12 din cinci baraje). ( b ) Vasoconstricția mediată de Ang II în arterele mezenterice ale descendenților (n = 5, fiecare grup). ( c, d ) efectul losartanului sau PD123319 asupra vasoconstricției mediată de Ang II în arterele mezenterice ale descendenților (n = 5, fiecare grup). * P
( A, b ) Efectul GF109203X sau al nifedipinei asupra vasoconstricțiilor mediate de Ang II în arterele mezenterice ale descendenților (n = 5, fiecare grup). ( c, d ), Vasoconstricție indusă de PDBu și KCl în absența și prezența nifedipinei în arterele mezenterice ale descendenților (n = 5, fiecare grup). Date v d au fost exprimate ca procent din răspunsul maxim al acestui vas la KCl. * P # P
( A, b ) urme reprezentative ale curenților Cao 1.2 înregistrate de la celulele de control și HS. ( c ) Graficele I - V au arătat un curent intern crescut la +10 mV până la +50 mV în celulele HS (n = 20) comparativ cu martorul (n = 25). * P 0, 05). Inactivarea V1/2 a avut loc la -9,00 ± 1,29 mV pentru control și -6,24 ± 1,13 mV pentru celulele HS (P> 0,05). Nu a existat nicio diferență semnificativă între celulele de control și celulele HS în dependența de tensiune a activării și inactivării Ca în 1.2 (Figura 4).
( A, b ) Curenți tipici de inactivare obținuți în etape de +20 mV timp de 200 ms după aplicarea unei serii de potențiale de condiționare de 1000 ms de la -60 la +60 mV. ( c ) Dependența de tensiune a curbelor de activare a curenților de Ca în 1, 2 în control (n = 15) și celule HS (n = 11) (G, conductivitate; G max, conductivitate maximă). ( d ) Dependența de tensiune a curbelor de inactivare a curenților de Ca în 1, 2 în grupurile de control (n = 22) și HS (n = 19) (I, curent; I max, curent maxim). Urmele reprezentative ale curenților de activare sunt prezentate în Figura 3 ( A ) ( b ).
Imagine la dimensiune completă
PKC a, 5 izoforme și expresia Cao 1,2 și 1 c în arterele mezenterice
Analiza Western blot nu a arătat o diferență semnificativă în nivelurile de expresie ale subunităților α1c Cao 1.2 și ale izoformei PKC8 în arterele mezenterice dintre HS și grupul martor. Expresia mai mare a izoformei PKCα a fost detectată la descendenții HS (Figura 5).
Exprimarea PKC a, 8 izoforme și subunități Cao 1,2 și 1 c în arterele mezenterice ale descendenței (n = 5, fiecare grup). * P 9, 25 și PKC/Ca în 1.2 sunt critice în reacțiile vasoconstrictoare și de presiune. Ang II se leagă de AT1R pentru a activa fosfolipaza C și apoi hidrolizează fosfoinozidele de membrană la diacilglicerol pentru a activa PKC. 26, 27 PKC poate activa Cav 1.2 prin fosforilare directă 28 sau prin modificarea potențialului membranei prin inhibarea canalelor BK. Activarea Ca în 1.2 ar putea duce la influx de extracelular Ca 2+ și vasoconstricție.
Consumul excesiv de zahăr în timpul sarcinii poate duce la supraexprimarea AT1R la descendenți. În acest studiu, losartanul, un antagonist specific al AT1R, a abolit răspunsul vascular crescut la Ang II în grupul HS, în timp ce blocantul AT2R PD123319 nu a prezentat efecte semnificative asupra contracțiilor mediate de Ang II, sugerând că AT1R, nu AT2R, a mediat Ang II -vazoconstricție îmbunătățită și răspuns la presiune la descendenții HS. O dietă bogată în zahăr în timpul sarcinii vă poate modifica nivelul sanguin și cel hormonal, inclusiv nivelul glucozei și insulinei. Există interacțiuni cunoscute între RAS și alte sisteme endocrine asociate cu homeostazia glucozei. Într-un studiu anterior, hiperglicemia a reglat în sus componentele RAS necesare pentru sinteza și acțiunea Ang II, care pot contribui la hipertensiunea arterială asociată cu sindromul metabolic. Prin urmare, este rezonabil să sugerăm că modificările biochimice și endocrine după supradozajul prenatal al zahărului ar putea provoca modificări ale RAS la descendenți. De asemenea, am constatat că GF109203X suprimă vasoconstricția intensificată cu Ang II, sugerând că funcțiile PKC îmbunătățite joacă un rol în anginoconstricția vasoconstricției stimulate de Ang II la descendenții HS. Ca o componentă din amonte a căii Ang II, AT1R supraexprimat poate contribui la îmbunătățirea funcției PKC.
Diabetul mellitus gestațional poate duce la creșterea activității și distribuția crescută a mai multor izoforme PKC în organogeneza timpurie a țesuturilor, iar hiperglicemia ar putea crește activitatea PKC pe diferite probleme in vitro. 32, 33, 34 izoforme ale PKC, inclusiv PKCα, PKCγ, PKC8, PKCɛ și PKCζ, au fost detectate în arterele mezenterice de șobolan. Numai izoformele α și δ par a fi implicate în vasoconstricția indusă de PDBu. PKCa poate spori contracția celulară dependentă de Ca 2+ și supraexprimarea sa este asociată cu hipertensiune. Acest studiu a măsurat expresia PKCα și PKCδ pentru a determina dacă au fost implicați în îmbunătățirea funcției PKC. În plus, PDBu a fost utilizat pentru a testa activitatea PKC. Supraexprimarea PKCα, nu PKCα, a fost găsită la descendenții HS. Până în prezent, s-a demonstrat că hipoxia prenatală induce programarea epigenetică a genei PKCɛ în inima șobolanului. Astfel, factorii epigenetici pot fi unul dintre mecanismele de bază ale schimbării în PKCα, o zonă care merită investigații suplimentare. PDBu a produs o vasoconstricție mai mare la descendenții HS. În plus, nifedipina a inversat vasoconstricția îmbunătățită cu PDB, sugerând că calea PKC/Cao 1.2 modificată poate contribui la tonusul vascular îmbunătățit cu Ang II.
În concluzie, experimentele cu microvase și celule sugerează căi potențiale care pot fi asociate cu activitatea crescută a căii PKC/Ca în 1.2 și sunt asociate cu modificări ale AT1R, PKCa și Ca în 1.2. Aceste observații pot oferi noi perspective asupra mecanismelor care stau la baza răspunsului îmbunătățit Ang II și a tonusului vascular la descendenții expuși la zahăr prenatal ridicat. Aceste informații sunt o contribuție importantă la înțelegerea noastră a prevenirii timpurii sau a tratamentului bolilor cardiovasculare programate in utero .
- Granule pentru câini care conțin carne - Gosbi
- Vedetele filmului, în așteptarea bucuroasă a consiliului, anunță vestea sarcinii lor cu altele neconvenționale
- Pacienții slovaci nu vor să iasă la dietă - Acasă - Știri
- FitKao - singura băutură de cacao pentru o dietă proteică 300 g
- Fructe proaspete cu conținut scăzut de zahăr
