obiecte
abstract
Modificările microflorei intestinale joacă un rol cheie în fiziologia și metabolismul gazdei; cu toate acestea, căile moleculare care stau la baza acestor modificări ale obezității induse de dietă sunt neclare. Ținta mecanicistă a căii de semnalizare rapamicină (mTOR) este asociată cu tulburări metabolice precum obezitatea și diabetul de tip 2 (T2D). Prin urmare, am investigat dacă modificările induse de dietă în reglarea semnalizării mTOR (dietă bogată în grăsimi [HFD] sau dietă alimentată cu diete) și/sau terapeutice (resveratrol [inhibitor specific al complexului mTOR 1]) sau rapamicină [inhibitor al ambelor complexele mTOR 1 și 2]) au modificat compoziția microflorei intestinale la șoareci. Administrarea orală de resveratrol a prevenit intoleranța la glucoză și acumularea de grăsimi la șoarecii hrăniți cu HFD, în timp ce rapamicina a afectat semnificativ toleranța la glucoză și inflamația intestinală. Abundența Lactococcus, Clostridium XI, Oscillibacter și Hydrogenoanaerobacterium a crescut în condiții HFD; cu toate acestea, abundența acestor specii a scăzut după tratamentul cu resveratrol. În schimb, numărul Marinilabiliaceae neclasificate și Turicibacter a scăzut ca răspuns la HFD sau rapamicină. Luate împreună, aceste rezultate au arătat că modificările compoziției microbiozei intestinale induse de modificările activității mTOR se corelează cu fenotipurile obeze și diabetice.
Obezitatea este un factor de risc major pentru diferite boli cronice, inclusiv diabetul de tip 2 (T2D), bolile cardiovasculare, hipertensiunea arterială, boala hepatică grasă nealcoolică și cancerul 1. Cauza principală a obezității este un dezechilibru între aportul de energie din alimente și consumul de energie prin metabolismul bazal, activitatea fizică și termogeneza 2. Deoarece metabolismul bazal (BMR) reprezintă aproximativ 60-75% din cheltuielile totale de energie 2, BMR scăzut pe unitate de greutate corporală este unul dintre factorii de risc pentru obezitate 3. În plus, echilibrul energetic este afectat de interacțiunile complexe dintre factorii genetici, de mediu și psihosociali 4. În ceea ce privește aportul de energie, modificările motilității gastro-intestinale (GI) contribuie la obezitate prin reglarea nu numai a eficienței digestive, ci și a apetitului și sațietății 5. Interesant este faptul că studii recente sugerează că microflora intestinală joacă un rol important în colectarea de energie și obezitate prin interacțiuni cu motilitatea GI 6, 7 .
Aici, am investigat efectele resveratrolului și rapamicinei asupra semnalizării mTOR, expresiei markerului metabolic și compoziției microflorei intestinale atât la șoarecii normali, cât și la șoarecii DIO. Rezultatele arată că resveratrolul și rapamicina au efecte semnificative nu numai asupra activității de semnalizare mTOR și a expresiei markerilor metabolici, ci și asupra compoziției microflorei intestinale, sugerând că grupurile microbiene specifice se corelează cu fenotipurile fiziopatologice asociate cu obezitatea și T2D.
Rezultatul
Resveratrolul, dar nu rapamicina, ameliorează obezitatea indusă de HFD
După cum era de așteptat, greutatea corporală (BW) și depozitarea grăsimilor la șoarecii hrăniți cu HFD au fost mai mari decât la șoarecii hrăniți cu o dietă normală (NCD) (P 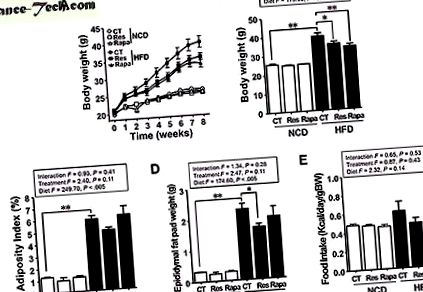
( A, B ) Nivelurile de glucoză din sânge (măsurători repetate ANOVA bidirecțională după testul Bonferroni post hoc, F = 13, 88; P * P ** P # P ## P * P ** P * P ** P 24 și lungimea colonului. Concentrație Scaunul LCN-2 la șoarecii HFD-CT a fost semnificativ mai mare decât concentrația la șoarecii NCD-CT (P
Comunitățile bacteriene au fost grupate folosind analize UniFrac bazate pe distanță (PCoA). ( A ) Coordonata principală (PC) 1 față de PC2 și ( B ) PC1 versus PC3. Procentul de abatere în computerul grafic este marcat pe axe. ( C ) Graficele cu bare care prezintă incidența relativă (%) a diferitelor genuri de bacterii în diferite grupuri dietetice și de tratament. Fiecare grup de șoareci este reprezentat de un simbol sau coloană diferit pe axa x a graficului și fiecare punct sau coloană indică un eșantion (n = 5 per grup).
Imagine la dimensiune completă
Diferențe semnificative în reprezentarea relativă a bacteriilor intestinale în diferite grupuri dietetice și de tratament. Efect ( A, B ) resveratrol sau ( C, D ) rapamicina pentru un număr relativ de 7 sau 10 genuri bacteriene și o analiză ierarhică de grupare a acestor profiluri bacteriene pe baza distanțelor din Manhattan au fost examinate la șoareci hrăniți cu NCD și HFD. Datele sunt exprimate ca medie ± SEM (n = 5 per grup). Valorile F și p provin dintr-un ANOVA bidirecțional după testul Bonferroni post hoc (tabelul suplimentar S2). * P ** P # P ## P
Coeficienții de corelație Pearson includ hărți care arată asocierea dintre markerii metabolici și un număr de genuri specifice de bacterii după ( A ) resveratrol sau ( B ) tratamentul cu rapamicină. Datorită numărului mare de teste de corelație efectuate, a fost utilizat pragul de semnificație P 14. Deoarece metformina este un regulator cheie al semnalizării mTOR, acest studiu a investigat dacă mecanismele care stau la baza metabolismului central al energiei gazdei care sunt controlate prin reglarea diferențială a căii mTOR implică modificări ale compoziției microflorei intestinale.
În concluzie, rezultatele raportate aici arată că modificările compoziției microflorei intestinale datorate tratamentului cu resveratrol și rapamicină se corelează cu modificările BW, depozitarea grăsimilor, rezistența la insulină și inflamația intestinală la șoarecii DIO. Deși identitatea moleculelor specifice legate de HFD care îmbogățesc sau reduc anumite populații microbiene intestinale rămâne de identificat, semnalizarea mTOR pare a fi o componentă cheie în reglarea compoziției microflorei intestinale la șoarecii DIO.
metode
Prelevarea de probe
Probele de scaun au fost recoltate proaspăt după 8 săptămâni de tratament cu resveratrol sau rapamicină și apoi depozitate la -80 ° C. La sfârșitul perioadei de tratament, șoarecii au fost anesteziați cu izofluran (2-clor-2- (difluorometoxi) -1,1, 1-trifluor-etan) după o noapte de post (16 ore). Ficatul, intestinele, tampoanele de grăsime epididimale și probele de sânge au fost rapid colectate, spălate scurt în PBS și depozitate la -80 ° C până la procesare. Tampoanele de grăsime epididimale au fost ponderate pentru a calcula AI (g tampoane de grăsime epididimale/g BW-100). Serul a fost colectat din sânge folosind tuburi Microtrainer® (BD, Franklin Lakes, NJ) pentru analiza insulinei.
Analiza homeostaziei glucozei
GTT sau ITT au fost efectuate la sfârșitul perioadei de tratament. Șoarecii hrăniți peste noapte au primit încărcare de glucoză (1,5 g/kg greutate corporală) prin gavaj oral sau încărcare de insulină (0,75 U/kg greutate corporală) prin injecție intraperitoneală. Un contor de glucoză din sânge (Accu-Check Performa, Roche) a fost utilizat pentru a măsura nivelul glicemiei înainte și după administrarea de glucoză sau insulină. O evaluare actualizată a modelului homeostatic (HOMA2), care include HOMA2-IR (rezistență la insulină), HOMA2-% B (funcția celulelor beta pancreatice) și HOMA2-% S (sensibilitate la insulină), a fost utilizată pentru a calcula QUICKI și K ITT, precum cele descrise. anterior 23, 46, 47. Modelul HOMA2 a fost calculat utilizând nivelurile de glucoză în post și insulină în post măsurate înainte de sacrificiu și înainte de introducerea glucozei în GTT.
Test legat de imuno absorbția enzimelor
Pentru a evalua activarea atât a complexelor de semnalizare mTORC1, cât și a celor 2, probele de ficat au fost examinate folosind un kit de testare a parametrilor cAMP (șoarece/șobolan) (R&D Systems Inc., Minneapolis, MN) pentru nivelurile de celule cAMP și kituri ELISA sandwich PathScan (Cell Signaling Technology), Beverly, MA) pentru S6 total, S6 fosforilat (Ser235/236) și Akt total și Akt1 fosforilat (Ser473). Pentru a examina fosforilarea Akt1, s-au injectat 0,5 U de insulină pe kg de greutate corporală cu 10 minute înainte de recoltarea sângelui. Concentrațiile serice de insulină au fost măsurate folosind kitul ELISA de insulină AKRIN-011T (Shibayagi, Gunma, Japonia). Pentru a determina inflamația intestinală, nivelurile fecale de LCN-2 au fost măsurate folosind un kit Quantikine ELISA de la Lipocalin-2/NGAL (R&D Systems Inc., Minneapolis, MN) așa cum este descris de Chassaing și colab. 24. Toate ELISA au fost efectuate conform protocoalelor producătorului.
Extracția ADN, amplificarea bacteriană a genei ARNr 16S și 454 pirozecvențiere
ADN-ul metagenomic a fost extras din probe fecale (0,02 g per probă) folosind o metodă repetată de măcinare a mărgelelor plus o coloană așa cum este descris mai sus 14. Regiunile hiper-variabile V1 și V2 ale genei bacteriene 16S rRNA au fost amplificate din fiecare probă de ADN extrasă folosind primerul cod de bare 14. Cinci produse PCR replicate pe probă au fost combinate și purificate folosind kitul de purificare QIAquick PCR (Qiagen, Valencia, CA). ADN-ul grupat a fost secvențiat folosind pirosecvențierea 454 GS FLX Titanium (Roche 454 Life Sciences, Branford, CT). Secvențierea a fost efectuată folosind Macrogen (Seul, Coreea).
Analiza secvențelor genetice ale genei ARNr 16S și compararea comunității
analize statistice
Datele au fost exprimate ca medie ± SEM. Toate analizele statistice și coeficienții de corelație Pearson au fost efectuate utilizând software-ul GraphPad Prism (versiunea 6.0; GraphPad Software, SD, SUA). Hărțile de căldură ale coeficientului de corelație Pearson au fost vizualizate folosind Excel și PowerPoint (versiunea 2010; Microsoft Corporation, WA, SUA). În experimentele care au comparat mai multe grupuri, diferențele au fost analizate prin ANOVA bidirecțională urmată de testul post-hoc Bonferroni. GTT și ITT au fost analizate folosind măsuri repetate ANOVA bidirecțională cu timpul și grupul ca surse de variație. Valori P * P ** P
