obiecte
abstract
9-11 nm) cu diametrul porilor
rezultate și discuții
Interacțiunea Ang II cu canalele de lizenină crește modificările tranzitorii ale curentului ionic
Setarea experimentală de bază pentru analiza interacțiunilor dintre Ang II și canalele individuale de lizenină, care este comună pentru studiile de translocare a macromoleculelor, este descrisă în detaliu în secțiunea Metode. Inserarea unui singur canal de lizenină în membrană a fost indicată de un curent deschis constant
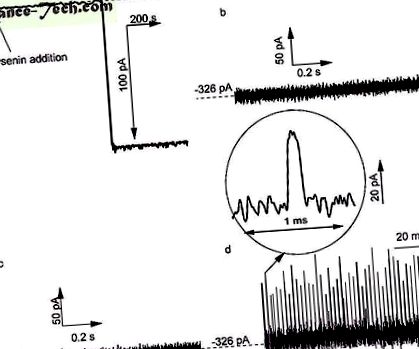
-122 pA la un potențial de distorsiune de -60 mV (Fig. La), după care soluția din rezervorul cis a fost schimbată cu electrolit fără lizină pentru a preveni inserarea ulterioară. Cu toate acestea, după schimbarea tamponului, pot fi inserate mai multe canale, deoarece formarea pre-porilor atașați la membrană este o condiție pentru oligomerizarea canalelor 36. Deși nu am găsit nicio modificare în semnăturile electronice caracteristice derivate din măsurători cu un singur canal pentru până la șase nanoporturi încorporate (după care zgomotul electric poate deveni semnificativ și poate preveni o analiză precisă), toate experimentele de translocație pe canale individuale conțineau în mod constant doi nanopori de lisenină asamblate în o membrană lipidică.
Interacțiunea Ang II cu canale de lizenină unice încorporate în membrane lipidice scăldate cu soluții KCl 1 M tamponate cu 10 mM Tris și 1 mM EDTA la pH 6,9. A ) Introducerea unui canal în membrana bistratificată a fost observată ca o schimbare pas a curentului ionic la un potențial transmembranar de -60 mV (timp de eșantionare 1 s, 1 kHz filtru hardware low-pass și 10 Hz filtru software low-pass . Nu s-au observat modificări tranzitorii ale curentului ionic determinate prin cele două canale deschise de lizină la -80 mV când: ( b ) nu s-a adăugat Ang II la soluție și ( c ) Ang II a fost adăugat la rezervorul trans. ( d ) Adăugarea Ang II la rezervorul cis a furnizat multiple modificări tranzitorii în curentul ionic, indicând interacțiuni canal-peptidă. Urmele afișate pe panouri ( b - d ) au fost înregistrate cu un timp de eșantionare de 4 μs și un filtru hardware de 10 kHz low pass.
Imagine la dimensiune completă
În absența analitului peptidic Ang II adăugat la soluțiile externe, urmele de curent ionic înregistrate pe cele două canale la -80 mV și rezoluția ridicată a timpului (timp de eșantionare de 4 μs) au arătat absența oricărei modificări tranzitorii în urma curentului deschis (Fig. . 1b) și zgomot redus (1 Ang II în rezervorul trans (faza principală) pentru condiții experimentale și interval de timp altfel identice (Fig. 1c), indicând faptul că o anumită direcție a câmpului electric împiedică orice interacțiune nanopor-analit. adăugarea peptidei la rezervorul cis la -80 mV potențial transmembranar a dat schimbări frecvente și scurte tranzitorii ale curentului ionic (Fig. 1d), indicând interacțiuni peptidice cu canalul deschis 13, 14, 15, 16, 42, 43 44, 45, 46 .
Cele două tipuri principale de evenimente înregistrate pot fi clasificate ca deplasări sau coliziuni
Schimbările bruște și tranzitorii ale curentului ionic induse prin adăugarea de Ang II pe partea cis sunt similare cu semnătura electronică a peptidelor care interacționează cu alți nanopori biologici 11, 14, 16, 43, 44, 45, 46. O analiză aprofundată a semnăturii tranzitorii electronice cu pachetul software Transalyzer 47 a fost efectuată pentru fiecare eveniment individual în ceea ce privește schimbarea medie curentă în timpul interblocării tranzitorii și timpul de staționare, tD. Graficul densității evenimentelor înregistrat la -80 mV (Fig. 2a) a arătat două clustere, un fenomen comun care apare pentru macromolecule translocate prin nanopori sintetici și naturali 11, 14, 43, 48. Prezența celor două clustere sugerează interacțiuni de semnal diferite ale canalelor peptidice, care pot reprezenta orientarea opusă a moleculelor care intră în nanopore 7, pliere, oligomerizare 11, legare 46 sau încercări de translocare nereușite atunci când moleculele se ciocnesc numai cu deschiderea canalului 14, 43. Clusterele prezentate în FIG. 2a sunt diferite și, prin urmare, pot fi ușor împărțite în două clase de evenimente numite E1 și E2. O analiză suplimentară a evenimentelor aparținând fiecărei clase a arătat o distribuție relativ îngustă și simetrică (Fig. 2b), cu vârfuri la -26 pA (evenimente E1) și -10 pA (evenimente E2).
Analiza evenimentelor de blocare înregistrate după adăugarea Ang II la rezervorul cis la -80 mV potențial transmembranar. ( A ) Graficul densității arată două clustere bine definite (numite E1 și E2), care au permis analiza separată a fiecărui cluster individual. Culoarea indică densitatea în funcție de scara inserată. ( b ) histogramele (lățimea rezervorului 3 pA) reprezintă vârfuri la -26 pA (evenimente E1) și -10 pA (evenimente E2). ( c ) Distribuția evenimentelor pentru fiecare dintre cele două clustere în termeni de tD este reprezentată de histograme (lățimea stivei 0,02 ms) cu vârfuri la
70 µs (evenimente E1) a
120 µs (evenimente E2). Pentru a observa mai bine distribuțiile suprapuse, a fost introdus un decalaj între coșurile de evenimente E2. Evenimentele analizate au fost colectate dintr-un experiment de translocare.
Imagine la dimensiune completă
descrierea evenimentelor E1 sau E2 reprezintă mai puțin de 25% din valoarea absolută a curentului deschis, care este o cantitate mult mai mică decât cea măsurată din experimentele care investighează translocația peptidelor sau a polinucleotidelor scurte peste alți nanopori biologici 8, 14, 16, 4349. Această discrepanță poate fi atribuită proprietăților structurale atât ale canalului, cât și ale peptidei. Structura recent publicată a lizeninei 35, 36 arată lungimea canalului
Distribuțiile tD pentru cele două clustere (Fig. 2c) înregistrate la -80 mV sunt oblice și asimetrice, cu vârfuri la
70 µs (evenimente E1) a
120 µs (evenimente E2). Spre deosebire de distribuțiile de blocuri actuale, care sunt bine separate, am observat o suprapunere mare între caracteristicile t Ds ale celor două tipuri de evenimente. În plus, evenimentele E1 au arătat o distribuție îngustă a tD, în timp ce evenimentele E2 au depășit intervalul de la 0,02 ms la mai mult de 0,4 ms (Fig. 2c). Măsurătorile ts anterioare pentru peptide sau oligonucleotide scurte translocate prin canale α-HL sau aerolizină prezintă distribuții care urmează descompunerile exponențiale descrise de timpii de relaxare caracteristici ca măsură a mediei Tn 11, 13, 14, 16, 43, 46, 49. Este posibil ca rezultatele noastre să nu se potrivească unei astfel de descrieri, deoarece niciuna dintre cele două clase de evenimente nu poate fi descrisă cu exactitate ca o combinație de descompuneri exponențiale.
Dependența de stres a interacțiunilor dintre canalele individuale de lizenină și Ang II. ( A ) Media evenimentelor E1 (pătrate deschise) a urmat tensiunea aplicată liniar așa cum era de așteptat pentru translocații. În schimb, tensiunea aplicată a avut un efect mult mai mic asupra blocului curent care caracterizează evenimentele E2 (pătrate solide). ( b ) Media t D a blocajelor tranzitorii a scăzut odată cu tensiunea aplicată pentru evenimentele E1 (pătrate deschise) și E2 (pătrate solide). Datele din ambele panouri sunt exprimate ca medie ± sd, n = 3; fiecare dimensiune a eșantionului a constat din cel puțin 2800 de evenimente.
Imagine la dimensiune completă
După cum am interpretat anterior, am atribuit evenimente caracterizate prin blocarea curentului mai redusă și timpi de interacțiune mai lungi care conțin molecule care afectează porii și se difuzează 14, 43. În schimb, blocaje de curent mai mari și timpi mai scurți au fost considerate caracteristice translocațiilor putative 14, 43. Ca rezultat, concluzionăm că evenimentele E1 sunt caracteristice moleculelor translocate, iar evenimentele E2 reprezintă coliziuni cu porii. Cu toate acestea, nu putem exclude complet posibilitatea grupării în FIG. 2a ca provenind din diferite orientări ale moleculelor care intră în porii 52, plierea peptidelor sau alte interacțiuni intermoleculare complexe între canalele de lisenină și peptidele 46. Semnătura electronică a peptidelor care trec prin nanopori depinde în mare măsură de natura analitului și a nanoporului, ceea ce face dificilă compararea experimentelor de translocație pentru care niciunul nu este același.
Am investigat în continuare efectul tensiunii aplicate asupra frecvenței evenimentelor pentru două populații diferite. Așa cum se arată în FIG. 4, frecvența evenimentelor E1 sau E2 a crescut cvasi-liniar pe măsură ce amplitudinea tensiunii transmembranare a crescut, ceea ce a fost observat anterior în translocația nucleotidelor scurte sau a peptidelor 8, 13. Distribuția largă a valorilor de frecvență experimentale, după cum se arată în marile game de erori, poate fi explicată prin amestecarea inegală a soluțiilor după adăugarea Ang II. De asemenea, am observat că frecvența evenimentelor a crescut în timp, ceea ce poate fi explicat prin acumularea electrică de peptide în apropierea deschiderii canalului. Este demn de remarcat faptul că numerele au fost distribuite relativ uniform între cele două populații, indiferent de tensiunea utilizată.
Influența tensiunii asupra frecvenței evenimentului. Frecvența evenimentului E1 ( A ) și E2 ( b ) estimat pentru un singur canal de lizină urmează tensiunea aplicată într-o manieră cvasi-liniară. Punctele experimentale reprezintă media ± sd, n = 3.
Imagine la dimensiune completă
Dovezi ale translocației: analiza LC-MS
22 700). așa cum este descris în secțiunea privind metodele).
După adăugarea Ang II în rezervorul cis (concentrație finală 10 μg ml -1) la -100 mV timp de aproximativ 36 ore, soluția a fost îndepărtată din rezervorul trans pentru analiză ulterioară. LC-MS a arătat prezența Ang II în proba standard și în soluția luată din rezervorul trans (Fig. 5a-d), indicând trecerea Ang II printr-o membrană care conține o populație mare de canale de lizenină. Cantitatea de Ang II translocată (
0,8 ng) estimat din curba de calibrare MS-LC a cantităților standard a fost utilizat pentru a calcula frecvența de translocație
Dovezi ale translocației Ang II pe populații mari de canale de lizenină încorporate într-o membrană lipidică plană. ( A ) MS al soluției de referință Ang II (100 ng) a identificat peptida la m/z = 349,5 (z = 3+). b ) Cromatogramă LC a soluției de referință Ang II. Moleculele peptidice translocate în rezervorul trans la -100 mV timp de 36 de ore au fost detectate și identificate de SM ( c ) și LC ( d ). Aplicație de tensiune +100 mV ( e ) sau blocarea canalului de chitosan ( f ) nu a permis detectarea LC a Ang II în rezervorul trans.
Imagine la dimensiune completă
Se poate argumenta că, în condițiile experimentale de mai sus, câmpul electric opus poate preveni, de asemenea, translocația prin membrana cu scurgeri sau că canalele de lizenină pot prezenta o tensiune prin acceptarea stărilor subconductive 41 caracterizate printr-un diametru al căii conductoare redus, care este incompatibil cu molecula mare. translocare. Prin urmare, am efectuat un experiment similar în care membrana a fost deviată cu -100 mV (pentru a promova translocația), dar canalele de lisenină au fost expuse chitosanului, un blocant de conductivitate ireversibil al canalului de lizenină 58. Analiza LC a probelor extrase din rezervorul trans nu a arătat prezența Ang II (Fig. 5f). Deși este posibil ca translocarea spontană a Ang II să aibă loc la niveluri sub limita de detecție LC-MS, este clar că canalele deschise de lizenină inserate în membrană au fost responsabile de medierea translocației Ang II controlate electroforetic observate în acest studiu. Împreună cu semnătura electronică înregistrată pe canalele individuale de lizenină în prezența peptidei, munca noastră demonstrează că canalele de lizenină permit peptidei să traverseze membrana prin calea conductivă a nanoporului.
concluzii
Am demonstrat cu succes că canalele de lizenină încorporate în membranele lipidice facilitează translocarea moleculelor peptidice antrenate electroforetic de câmpurile electrice. Acest studiu adaugă lizenina la o listă scurtă de proteine promițătoare formatoare de pori adecvate pentru dezvoltarea dispozitivelor de detectare și caracterizare inspirate de natură. Diametrul mare și uniform al canalului poate conține molecule care sunt prea mari pentru a putea fi deplasate de alte nanoporme biologice, extinzând astfel capacitățile de scanare a nanometrilor pentru alți analiți biomoleculari. Ingineria ulterioară a canalelor prin modificări chimice și mutageneză direcționată la fața locului pentru a implementa capacități de detectare îmbunătățite sau chiar noi este acum posibilă datorită datelor structurale recente ale porilor asamblate 35, 36. În plus, canalele de lizenină reprezintă mecanisme de reglare neobișnuite prin stimuli fizici și chimici, precum tensiunea sau liganzii 41, 54. Modularea externă a stării conductive poate fi utilizată în continuare pentru transportul controlat al moleculelor bioactive prin membranele lipidice naturale și artificiale, permeabilizarea temporară a celulelor, sistemele de livrare a medicamentelor, comutatoarele inteligente și bioelectronica.
metode
Pregătirea lipidelor bilaterale Pregătirea membranei și inserarea canalelor
Schiță simplificată a configurației experimentale pentru translocația Ang II. Canalele individuale de lizină încorporate în membranele lipidice cu strat dublu plan afectate de solicitări transmembranare pot facilita translocația controlată electroforetic a macromoleculelor pe o cale conductivă mare. Dimensiunile canalului sunt de la ref. 35.
Imagine la dimensiune completă
Translocarea peptidei prin canale individuale de lizenină
Ang II a fost adăugat la rezervorul cis la o concentrație finală de 1 μg ml-1, urmat de agitare timp de aproximativ 10 secunde. Evenimentele tranzitorii au fost înregistrate cu un protocol de lungime variabilă la un timp de eșantionare de 4 µs, 1 ms înainte și după pornire, un filtru hardware de 10 kHz și stocate pentru analiză folosind Clampfit 10.2 (Dispozitive moleculare), Transalyzer 47, Matlab (Mathworks), și pachete software 8.5 (OriginLab Corporation). Timpul de ședere a fost calculat ca jumătate maximă maximă pentru fiecare eveniment individual selectat pentru analiză, iar amplitudinile curente au fost calculate ca nivelul mediu dintre primul și ultimul minim local al fiecărui eveniment 47. Această procedură a asigurat cea mai bună separare între evenimentele E1 și E2.
Inserarea unor populații mari de canale de lizină
Protocolul experimental pentru inserarea mai multor canale într-un strat stratificat a fost similar cu canalele individuale, dar a inclus un diametru mai mare pentru gaura din filmul PTFE (
180 μm în medie pentru a găzdui populații mai mari de canale). O cantitate mai mare de lizenină a fost adăugată în rezervorul cis (până la 20 μl de 1 μM) și s-a utilizat un volum mai mic de electrolit în rezervorul trans (100 μl). Numărul total de canale inserate a fost crescut treptat prin adăugarea treptată a lizeninei până la atingerea unui curent ionic constant.
-180 nA la -4 mV tensiune transmembranară și apoi electrolitul tamponat a fost schimbat pentru a elimina lizenina din soluția în vrac. Numărul de canale prezente în membrană (
22.700) a fost estimată din raportul dintre conductivitatea totală a membranei determinată din curba IV înregistrată pentru domeniul îngust de tensiune (Fig. 7) și conductivitatea individuală a canalului (Fig. 7).
Grafic IV pentru populații mari de canale de lizenină încorporate într-o membrană lipidică cu două straturi. Conductivitatea calculată din panta curbei a fost utilizată pentru a estima numărul de canale inserate.
Imagine la dimensiune completă
Blocarea canalelor de lizenină de către chitosan. Adăugarea chitosanului a indus o scădere permanentă și ireversibilă a conductivității macroscopice la potențial transmembranar de -4 mV, indicând blocarea canalului.
Imagine la dimensiune completă
Analiza LC-MS
Mulțumiri
Cercetările prezentate în această publicație au fost susținute de Fundația Națională pentru Științe (numerele de grant 1554166, 0923535), Institutele Naționale de Sănătate (numerele de grant P20GM109095, P20GM103408) și Administrația Națională pentru Aeronautică și Spațiu (numărul de grant NNX15AU64H). Conținutul este responsabilitatea exclusivă a autorilor și nu reprezintă neapărat opiniile oficiale ale agențiilor de ajutor.
Comentarii
Prin trimiterea unui comentariu, sunteți de acord să respectați Termenii și condițiile și Regulile comunității. Dacă considerați că acesta este un act ofensator care nu este conform cu termenii sau liniile directoare, vă rugăm să îl marcați ca fiind inadecvat.
- Sindromul intestinului iritabil îmi irită viața cu durere cronică - Sfaturi 2021
- Top 6 moduri de a ajusta metabolismul - Sfaturi 2021
- Test - cele mai bune anvelope pentru toate anotimpurile 2021 recenzii
- Opriți-vă și Uitați-vă, cancerul se încheie cu mine - Boala 2021
- Test grătar pe cărbune 2021 - clasamentul celor mai bune