abstract
Context/Obiective:
Mușchiul scheletic joacă un rol important în reglarea metabolismului întregului corp. În mușchiul scheletic, creșterea nivelului de glucoză și acid gras în circulație este facilitată de transportorii de substrat transmembranar GLUT4 și FAT/CD36. Scopul acestui studiu a fost de a determina efectul indicelui glicemic nutrițional (GI) asupra expresiei genelor GLUT4 și FAT/CD36 în mușchiul scheletic uman după un singur atac de efort.
Subiecte/metode:
Opt subiecți de sex masculin au fost supuși unui exercițiu ciclic de 60 de minute la 75% din consumul maxim de oxigen (VO2 max) și au fost hrăniți imediat cu o masă izoclorică care conțin fie o dietă bogată GI (HGI), fie GI scăzută (LGI), cu un raport similar de carbohidrați, grăsimi și proteine în proiectarea încrucișată. Probele de mușchi din vastul lateral profund au fost prelevate prin biopsie cu ac imediat după efort și 3 ore după efort.
rezultatele:
După exerciții fizice, dieta HGI a produs răspunsuri semnificativ mai mari la glucoză și insulină în comparație cu dieta LGI, așa cum se arată într-o zonă mai mare sub curbe. Ambele diete au dus la o scădere rapidă a acizilor grași din plasmă și a glicerolului sub nivelurile postului. GLUT4 MRNA a fost reglat în jos atât de dietele HGI, cât și de cele LGI într-o măsură comparabilă, în timp ce nivelurile de proteine GLUT4 nu s-au modificat în această perioadă scurtă. Nivelurile de mARN și proteine FAT/CD36 au fost reduse semnificativ odată cu dieta HGI sub valoarea inițială, dar nu și cu dieta LGI.
concluzie:
În acest studiu, s-a constatat un efect GI semnificativ dietetic asupra expresiei genei FAT/CD36 după exerciții la mușchiul scheletic uman. Acest rezultat sugerează că diferențele în GI dietetic sunt suficiente pentru a modifica metabolismul grăsimilor.
Mușchiul scheletic este un sit major al utilizării grăsimilor și carbohidraților în întregul corp (Zurlo și colab., 1990) și prezintă o plasticitate remarcabilă ca răspuns la modificările cererii metabolice și la disponibilitatea substratului. Modificările metabolice ale acestui țesut ar putea afecta metabolismul întregului corp. GLUT4 și FAT/CD36 sunt două proteine responsabile de transportul glucozei și acizilor grași circulanți peste membrana plasmatică în mușchiul scheletic. La om, nivelurile de ARNm GLUT4 pot crește rapid după un singur atac de exerciții pe termen lung (Kraniou și colab., 2006) și reglate în jos printr-o dietă bogată în carbohidrați (Cheng și colab., 2005). La șobolanii cu mușchi scheletici, suplimentarea cu carbohidrați post-exercițiu poate induce proteina GLUT4 prelungită timp de câteva ore, în timp ce ARNm GLUT4 scade temporar sub valoarea inițială în 90 de minute (Kuo și colab., 1999a).
Disponibilitatea glucozei intramusculare și a semnalizării insulinei par să regleze metabolismul acidului gras prin reglarea expresiei genei transportoare de acizi grași FAT/CD36 (Civitarese și colab., 2005). Nivelurile de proteine și ARNm pentru FAT/CD36 pot fi crescute în mușchiul scheletic prin injecție cu streptozotocină (Luiken și colab., 2002), un tratament care afectează producția de insulină pancreatică și astfel elimină absorbția glucozei din mușchii scheletici. În mod similar, rezistența la insulină crește, de asemenea, expresia genei FAT/CD36 (Smith și colab., 2007).
Similar cu proteina GLUT4, s-a demonstrat că antrenamentul pentru exerciții fizice crește nivelurile de proteine FAT/CD36 (Tunstall și colab., 2002). Comparativ cu o dietă bogată în grăsimi/cu conținut scăzut de carbohidrați, sa constatat că o dietă bogată în carbohidrați/cu conținut scăzut de grăsimi reduce activitatea proteinelor FAT/CD36 după exercițiu (Arkinstall și colab., 2004). Cu toate acestea, o dietă bogată în grăsimi poate afecta, de asemenea, expresia genei FAT/CD36 în mușchiul scheletic uman (Duplus și colab., 2000; Cameron-Smith și colab., 2003). Până în prezent, se știe puțin dacă diferitele valori ale indicelui glicemic (GI) cu niveluri similare de carbohidrați, grăsimi și proteine pot provoca efecte diferențiale în expresia genei proteinelor FAT/CD36 și GLUT4. În acest studiu, au fost examinate două diete izocilore bogate în carbohidrați, cu conținut similar de carbohidrați, grăsimi și proteine, dar valori GI diferite, pentru a determina expresia genei GLUT4 și FAT/CD36 în mușchiul scheletic uman. Am constatat anterior că o modificare a nivelurilor de ARNm GLUT4 printr-o dietă cu carbohidrați are loc în decurs de 3 ore (Cheng și colab., 2005). Astfel, a fost prelevată o probă de mușchi uman la începutul tratamentului (pe stomacul gol) și la 3 ore după suplimentarea dietei după exerciții, după măsurătorile de mai sus.
Materiale și metode
obiecte
Probele de biopsie musculară Vastus lateralis au fost obținute de la opt voluntari sănătoși (vârsta 22,5 ± 0,3 ani, înălțimea 174,2 ± 1,3 cm, greutatea 69,1 ± 1,9 kg, indicele de masă corporală (IMC) 22, 7 ± 0,5 kg/m2, consumul maxim de oxigen (VO ) 2) max 49,7 ± 0,9 ml/min/kg). Comitetul de Etică al Spitalului Creștin Changhua a aprobat protocolul. Natura, scopul și riscurile posibile au fost explicate fiecărei entități înainte de obținerea consimțământului scris. Această lucrare a fost efectuată în conformitate cu liniile directoare ale Declarației de la Helsinki.
exercițiu
Cu 2 zile înainte de exercițiu, se măsoară VO2 max al tuturor subiecților. În ziua experimentului, subiecții au raportat la laborator la ora 08:00. După încălzire timp de 5 minute, pacienții au efectuat un exercițiu ciclic de 60 de minute la 75% VO 2max. Apa potabilă a fost furnizată ad libitum în timpul și după exerciții. Biopsia musculară a fost efectuată pe stomacul gol (linia de bază) și alimentată după efort. Pentru condițiile de post, nu s-a furnizat alimente timp de 3 ore după exercițiu. În starea de hrănire, subiecților li s-au oferit diete care conțin 70% carbohidrați cu două IG diferite după efort. Crossover-ul a fost separat timp de 1 săptămână. Probele de biopsie musculară au fost obținute imediat după efort și la 3 ore după ingestie pentru transcriere inversă-PCR (RT-PCR) și analiza Western blot.
bebelus
Imediat după exercițiu, subiecților li s-au administrat diete GI ridicate (HGI, = 76, 6) sau GI scăzute (LGI = 36, 1) și consumate în decurs de 10 minute de la exercițiu. Aportul de energie după exerciții fizice în condiții HGI și LGI a fost de 678, 2 ± 18, 7 kcal (carbohidrați 138, 03 ± 0,8 g; proteine 19, 4 ± 0,5 g și grăsimi 5, 4 ± 0,1 g) și 682, 2 ± 18, 8 kcal (zaharidă 137, 7 ± 3, 8 g; proteine 18, 5 ± 0, 5 g și grăsimi 6, 4 ± 0, 2 g). Dieta HGI a inclus fulgi de porumb (60,2 g), lapte degresat (245 ml), pâine albă (80,5 g), gem (20,3 g), apă cu glucoză (126 ml) și apă (560 ml).). Conținutul LGI al dietei a inclus toate tărâțe (61,6 g), lapte degresat (329 ml), piersici (280 g), mere (210 g) și suc de mere (164,5 ml).
Colectarea țesutului muscular
Biopsia musculară a fost efectuată sub anestezie locală (lidocaină 2% fără adrenalină). O incizie de 10 mm lungime și aproximativ 20 cm adâncime deasupra genunchiului a fost efectuată în pielea și fascia musculară utilizând tehnica aseptică. Biopsiile Vastus lateralis (aproximativ 50 mg) au fost efectuate folosind tehnica de biopsie percutanată a lui Bergstrom (1962). Probele au fost șterse uscate și tăiate aproximativ fără grăsime și țesut conjunctiv, congelate în azot lichid și depozitate la -80 ° C înainte de analiza RT-PCR și Western blot.
Prelevarea și analiza sângelui
Transcriere inversă-PCR
Western blot
Mușchii au fost omogenizați în 20 mL de acid 4- (2-hidroxietil) -1-piperazinetansulfonic rece cu gheață, acid etilendiaminetetraacetic 1 mM și 250 mM tampon zaharoză (pH 7,4) cu un polytron (Brinkmann Instruments, Westbury, NY, SUA) . ). Conținutul de proteine din fiecare probă a fost cuantificat utilizând testul Lowry. Cantități egale de proteine au fost denaturate și separate pe gel de electroforeză cu gel de poliacrilamidă 7,5% cu dodecil sulfat de sodiu și apoi transferate pe membrane poli (viniliden difluorură) (New Life Science Product, Inc., Boston, MA, SUA). Siturile de legare nespecifice pe membrane au fost blocate cu lapte praf degresat 5% în tampon conținând 10 mM Tris-HCI și 100 mM NaCI, pH 7,5 și menținut la 4 ° C peste noapte. Bloturile au fost apoi incubate secvențial cu GLUT4 (1: 250, Chemicon, Billerica, CA, SUA) sau anticorpi primari FAT/CD3 (1: 5000, Santa Cruz, Santa Cruz, CA, SUA) și anticorpi conjugați cu peroxidază de hrean (1 ).: 5000, Perkin-Elmer, Boston, MA, SUA). Complexele antigen-anticorp au fost vizualizate, detectate și cuantificate folosind un kit de detectare Western blot ECL (Amersham Pharmacia Biotech, Piscataway, NJ, SUA), un analizor de luminiscență (Fujifilm, Japonia) și un densitometric nul Dscan (Scanalytics, Inc., FairFax, VA)., SUA).
analize statistice
Diferența medie a tuturor măsurătorilor a fost comparată prin analiza bidirecțională a varianței cu măsurători repetate. Testul post hoc al lui Tukey, care presupune că valoarea erorii de tip I este 0,05 pentru fiecare test, a fost utilizat pentru a distinge diferențe semnificative între perechile de afecțiuni dietetice. Datele sunt prezentate ca medie ± Estimarea puterii SD a fost efectuată pentru a determina dimensiunea eșantionului. Au fost necesare cel puțin șase subiecți pentru a obține performanțe de 80%. În acest studiu, am avut opt subiecți, așa că am întâlnit dimensiunea eșantionului necesară pentru a detecta diferențele statistice.
Rezultatul
Pacienții au suferit o reacție ciclică de 60 de minute la 75% VO 2max și au fost obținuți în condiții de post, LGI și HGI. În timpul recuperării, probele de sânge au fost prelevate la fiecare 30 de minute până la 3 ore pentru a monitoriza clearance-ul glucozei. Figura 1 prezintă rezultatele nivelurilor de glucoză plasmatică (a) și insulină (b) după dietă. Concentrațiile plasmatice de glucoză și insulină au atins un maxim la 30 de minute după dietă și apoi au scăzut în 3 ore. Concentrațiile plasmatice de glucoză și insulină din dieta HGI au fost semnificativ mai mari decât dietele de post și LGI (P 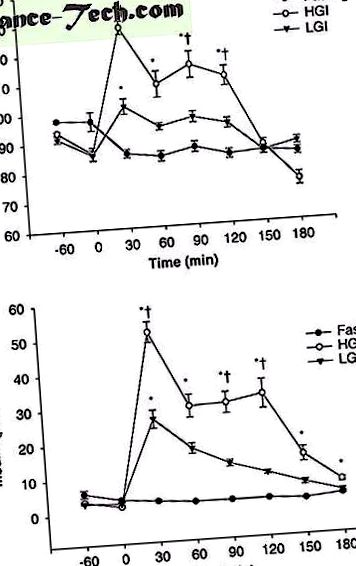
Concentrațiile plasmatice de glucoză ( A ) și insulină ( b ). * Diferență semnificativă față de nivelul postului (P † Diferență semnificativă față de indicele glicemic scăzut (LGI)) (P
Concentrațiile plasmatice ale acizilor grași neesterificați (NEFA) ( A ) și glicerol ( b ). * Diferență semnificativă față de nivelul postului (P
Nivelurile de ARNm GLUT4 în mușchiul vastus lateralis uman. * Diferență semnificativă față de nivelul postului (P † Diferență semnificativă imediat după exercițiu (P †
Nivelurile de proteine GLUT4 în mușchiul vastus lateralis uman.
Imagine la dimensiune completă
Nivelurile de ARNm și proteine ale mușchiului FAT/CD36 sunt prezentate în Figurile 5 și 6. Nivelurile de ARNm și proteine ale FAT/CD36 nu au diferit între dieta de repaus alimentar și LGI. Dieta HGI a redus semnificativ atât nivelul de ARNm FAT/CD36, cât și nivelul de proteine sub valoarea inițială (P
Nivelul de ARNm FAT/CD36 în mușchiul vastus lateralis uman. * Diferență semnificativă față de nivelul postului (P † Diferență semnificativă imediat după exercițiu (P †
Nivelul proteinei FAT/CD36 în mușchii vastului lateral uman. Valorile sunt raportate ca medie ± se (n = 6). * Diferență semnificativă față de nivelul postului (P † Diferență semnificativă imediat după exercițiu (P †
- Inoc dasterasteridă pentru nivelurile intraprostatice de dihidrotestosteron la bărbații cu benigne
- Alte furtuni magnetice asupra simptomelor umane și cum se poate reduce efectul problemelor de sănătate asupra iLive
- Inok al virusului imunodeficienței umane pe rezultatul tratamentului endodontic British Dental Journal -
- Meniuri pentru grădiniță și excepții alimentare - p
- Meniuri pentru grădiniță și excepții alimentare - p
