obiecte
abstract
Am raportat recent că clofazimina (CF) are activitate anti-piroplasmatică, dar nu ar putea elimina complet paraziții din gazdă. Medicamentul anti-piroplasmă disponibil în prezent, diminazenoacetat (DA), are uneori efecte secundare toxice. În acest studiu, am evaluat terapia combinată cu CF și DA împotriva piroplaselor in vitro și in vivo. În plus, nivelul de ARNm și cantitatea de ADN au fost analizate în Babesia bovis tratată cu CF‒ și DA 'prin qPCR. Combinația CF - DA a avut un efect aditiv asupra Babesia bovis, B. bigemina și B. caballi și efecte sinergice asupra Theileria equi. Chimioterapia combinată CF-DA împotriva B. microti la șoareci a fost mai eficientă decât monoterapia lor. În B. bovis tratate cu CF‒ și DA, nivelurile de ARNm dependente de doză-regulată de ARNm și cantitatea de gene extranucleare de ADN (bogate în AT), în timp ce DA a reglat în jos doar cantitatea de gene extranucleare de ADN, dar genele nucleare. genele au fost ușor reglementate în jos sau în sus de CF și DA. În cele din urmă, combinația CF-DA are o eficacitate mai mare împotriva piroplasmelor decât CF sau monoterapia DA. CF și DA pot avea activitate de legare a ADN-ului bogată în AT. Toate rezultatele sugerează că chimioterapia combinată CF-DA va fi o alegere mai bună pentru tratamentul piroplasmozei în locul monoterapiei DA.
Babezioza bovină și piroplasmoza ecvină provoacă pierderi economice uriașe în întreaga lume, în special în zonele tropicale și subtropicale 1, 2. Medicamentele anti-piroplasmă disponibile în prezent, diminazenoacetatul (DA) și dipropionatul de imidocarb au uneori efecte secundare toxice 3. În plus, au fost raportate Babesia gibsoni rezistente la DA și dezvoltarea Theileria equi 4, 5 rezistentă la dipropionat imidocarb. Prin urmare, sunt necesare urgent chimioterapii antipiroplasmatice mai puțin toxice, ieftine și eficiente.
Am raportat recent că clofazimina (CF) are un puternic efect inhibitor asupra creșterii piroplasiei, dar CF nu a putut elimina complet B. microt la șoareci 6. CF este un antibiotic utilizat în chimioterapie combinată împotriva leprei 7. S-a raportat că CF duce cu greu la dezvoltarea rezistenței 8, dar Zhang și colab. 9 a raportat recent că mai multe mutații ale genelor sunt asociate cu rezistența la CF la bacterii.
În acest studiu, am investigat efectul combinației CF-DA asupra creșterii in vitro a B. bovis, B. bigemina, B. caballi și T. equi și a activităților sale chimioterapeutice împotriva B. microti la șoareci. În plus față de testele de inhibare a creșterii, activitățile de legare a ADN-ului bogate în AT au fost studiate pentru a determina modul de acțiune al CF și DA în B. bovis folosind un test PCR cantitativ (qPCR).
rezultate si discutii
Tabel în dimensiune completă
Tabel în dimensiune completă
Tabel în dimensiune completă
Tabel în dimensiune completă
În conformitate cu studiul anterior 6, efectul 20 mg/kg CF a fost comparabil și uneori mai mare decât efectul 25 mg/kg DA. Prin urmare, 25 mg/kg, care este cea mai mare doză, a fost considerată linia de bază pentru selecția dozei în terapiile combinate în experimentul de la șoarece. În plus, raporturile de doză inegale în combinații în testul de inhibare in vivo sunt similare cu cele din testul de inhibare in vitro. Creșterea B. microti a fost semnificativ inhibată în toate grupurile de tratament (II-25 mg/kg DA, III-20 mg/kg CF, IV-15 mg/kg CF și 10 mg/kg DA și V-10 mg/kg) . kg CF și 15 mg/kg DA) în comparație cu grupul netratat (I-0,2 ml ulei de susan și soluție salină) (Fig. 1). Diferență mai mică semnificativă statistic (P 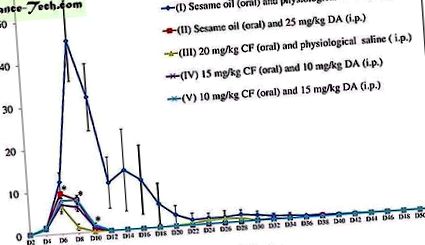
Creșterea B. microti la netratate (I), 25 mg/kg DA (II) -, 20 mg/kg CF (III) -, 15 mg/kg CF și 10 mg/kg DA combinație (IV) - și 10 șoareci cu doză de mg/kg CF și 15 mg/kg DA combinație (V) timp de 52 de zile. Săgeata indică 5 zile consecutive de tratament. Asteriscurile indică semnificativ statistic (P
Valorile hematocritului în combinații netratate, 25 mg/kg DA -, 20 mg/kg CF -, 15 mg/kg CF și 10 mg/kg DA combinații - și 10 mg/kg CF și 15 mg/kg DA combinații de șoareci tratați . Săgeata indică 5 zile consecutive de tratament. Asteriscurile indică semnificativ statistic (P
Detectarea prin PCR a B. microti de la șoareci tratați cu CF‒ sau DA 'în ziua 52 după infecție. A ) în probe de ADN din sânge: G1, netratate; G2, 25 mg/kg DA; G3, 20 mg/kg CF; Combinație de G4, 15 mg/kg CF și 10 mg/kg DA; Combinație de G5, 10 mg/kg CF și 15 mg/kg DA. ( b - f ) în probe de ADN tisular: M, mărime marker 100 bp; PC, control pozitiv; Fr. Sp., Splină; Li., Ficat; Ki., Rinichi; El, inima, NC, control negativ. Benzile duble observate în unele controale pozitive reprezintă ampliconii primului și celui de-al doilea PCR. S-a observat o singură bandă pentru a reduce concentrația de ADN șablon (datele nu sunt prezentate). ( g ) Infectivitatea B. microti la șoarecii transfuzați cu RBC. Parazitemia a fost calculată prin numărarea eritrocitelor infectate dintre 500 de eritrocite.
Imagine la dimensiune completă
Chimioterapiile combinate CF-DA sunt, în general, mai eficiente decât monoterapiile lor, în ciuda diferitelor regimuri de dozare utilizate atât în testele de inhibare in vitro, cât și in vivo, astfel încât chimioterapia combinată poate reduce efectele secundare toxice asupra gazdei. Cu toate acestea, ar trebui efectuate studii suplimentare pentru a identifica posibilele efecte secundare toxice asociate cu terapia combinată CF-DA pentru a confirma ipoteza noastră.
nivelurile de ARNm în B. bovis tratate cu CF sau DA. ( A ) 4 μM paraziți tratați cu CF și DMSO. ( b ) paraziți tratați cu CF 15 μM și tratați cu DMSO. ( c ) Paraziți tratați cu 6,5 μM DA și apă Milli-Q (M-QW). ( d ) paraziți tratați cu 19,5 μM DA și M-QW. Asteriscurile indică semnificativ statistic (* P 14, 15) Am emis ipoteza că o comparație a diferențelor în modificările ori ale nivelurilor de ARNm ale genelor nucleare, mitocondriale și apicolaste între paraziții tratați cu CF sau DA și cei paraziți netratați au relevat o asociere cu ADN-ul activitatea de legare a acestor medicamente. CF nu inhibă ARN polimeraza 8, iar activitățile de legare a ARN ale CF și DA sunt neclare, așa că am examinat cantitatea de gene ADN nucleare, mitocondriale și apicoplastice între CF- sau DA și paraziți netratați folosind testul qPCR .
Pentru analiza cuantificării ADN-ului, modificările ori ale cantității de gene extranucleare ale ADN-ului la paraziții tratați cu CF de 4 și 15 μM au fost dependente de doză comparativ cu paraziții tratați cu DMSO. genele pentru pisici nu erau și ușor reglementate (Fig. 5a și b). În plus, cantitatea de ADN a genelor nucleare nu a fost reglementată, în timp ce cantitatea de gene extranucleare a fost redusă la 6,5 μM paraziți tratați DA comparativ cu paraziții tratați cu M-QW (Fig. 5c). În cazul paraziților tratați cu 19,5 μM DA, s-a observat o reglare crescută a cantităților de ADN ale genelor nucleare, în timp ce o reglare descendentă a fost observată pe genele mitocondriale și apicoplastice în comparație cu controlul său (Fig. 5d).
Cantitatea de ADN din B. bovis tratată cu CF sau DA. ( A ) 4 μM paraziți tratați cu CF și tratați cu DMSO. ( b ) paraziți tratați cu 15 μM CF și tratați cu DMSO. ( c ) Paraziți tratați cu 6,5 μM DA și apă Milli-Q (M-QW). ( d ) paraziți tratați cu 19,5 μM DA și M-QW.
Imagine la dimensiune completă
Rezultatele qPCR sugerează că CF și DA se leagă de mitocondrii bogate în AT și apicolaste pentru a inhiba biosinteza ARNm și ADN a genelor extranucleare din B. bovis. În schimb, DA nu ar putea inhiba biosinteza ARNm a tuturor genelor, precum și CF și DA ar putea să nu fie toxice pentru ARNm și ADN biosinteza genelor nucleare.
În cele din urmă, combinația de CF-DA a arătat un efect aditiv asupra creșterii in vitro a B. bovis, B. bigemina și B. caballi și efecte sinergice asupra efectelor T. equi și chimioterapie combinată cu regimuri de doză mică de CF și DA au un efect inhibitor mai puternic asupra B microti la șoareci ca monochimioterapie a acestora. Un mod similar de acțiune a CF și DA, care este legat de activitatea bogată în AT, sugerează că aceste medicamente în combinație pot contribui la cooperarea împotriva paraziților Babesia. Toate aceste rezultate sugerează că chimioterapia combinată CF-DA este o alegere mai bună în tratamentul piroplasmozei animale comparativ cu monochimioterapia CF și DA. O evaluare suplimentară a eficacității terapiei combinate pentru B. bovis și B. bigemina la bovine și B. caballi și T. equi la cai va fi necesară pentru utilizarea viitoare a acestei terapii împotriva piroplasmozei la animale. În plus, studiul terapiei combinate cu CF și atovaquone, azitromicină sau clindamicină, care sunt în prezent medicamente disponibile pentru babezioza umană, ar trebui să fie preferat în studiile viitoare.
Materiale și metode
Declarație de etică
Toate experimentele pe animale au fost efectuate în conformitate cu reglementările privind gestionarea și funcționarea experimentelor pe animale și toate experimentele pe animale și ADN aprobate de Comitetul pentru îngrijirea și utilizarea animalelor și Comitetul de biosecuritate pentru agenți patogeni și Universitatea de Agricultură și Medicină Veterinară Obihiro, Hokkaido, Japonia (număr de accesare experiment animal: 28-110/28-111; experiment ADN: 201325-4/201321-4). Toate experimentele din acest studiu au fost efectuate în conformitate cu Ghidurile de bază pentru comportamentul animalelor și activitățile conexe din instituțiile de cercetare academică aflate sub jurisdicția Ministerului Educației, Culturii, Sportului, Științei și Tehnologiei, Japonia.
Paraziți și animale
Culturile in vitro ale tulpinii Texas de la B. bovis, tulpina argentiniană B. bigemina și tulpinile USDA B. caballi și T. equi au fost menținute așa cum s-a descris mai sus 25, 26, 27 .
Pentru modelul experimental pe animale s-a folosit o tulpină din München de B. microti și șoareci femele BALB/c în vârstă de opt săptămâni (cumpărate de la CLEA Japan, Inc., Tokyo, Japonia).
Substanțe chimice și reactivi
Toate substanțele chimice și reactivii au fost cumpărați de la Sigma-Aldrich (Tokyo, Japonia), cu excepția DA (Novartis Animal Health). CF și DA au fost dizolvate la 10 mM în DMSO și M-QW ca soluții stoc pentru testul de inhibare in vitro. Solvenții CF și DA (DMSO și M-QW) au fost utilizați în culturile martor la aceleași concentrații ca și cele utilizate pentru a prepara cea mai mare concentrație a acestor medicamente în fiecare test de inhibare in vitro. Pentru testul de inhibare in vivo, 10, 15 și 20 mg/kg CF și 10, 15 și 25 mg/kg DA au fost dizolvate în ulei de susan și soluție salină autoclavată (0,9% NaCl g/v, pH 7,2). chiar înainte de tratament.
Test in vitro de inhibare a combinației CF-DA
Evaluarea in vivo a activității chimioterapeutice a combinațiilor CF - DA
Testul de inhibare in vivo a fost efectuat așa cum s-a descris mai sus. Pe scurt, șoarecii (5/grup) au fost injectați intraperitoneal cu 1 x 10 7 B-micro-eritrocite infectate. Parazitemia și hematocritul au fost monitorizate la fiecare 2 și 4 zile prin microscopie și analizor automat de hematologie Celltac și MEK-6450 (Nihon Kohden Corporation, Tokyo, Japonia). Când s-a observat parazitemie peste 1% la toți șoarecii, grupurile I, II, III, IV și V au fost tratați cu 0,2 ml ulei de susan și soluție salină ca martor netratat, 0,2 ml ulei de susan și 25 m/kg DA, 20 mg ./kg CF și 0,2 ml soluție salină, 15 mg/kg CF și 10 mg/kg DA și 10 mg/kg CF și 15 mg/kg DA. CF și ulei de susan și DA și soluție salină au fost administrate pe cale orală și, respectiv, intraperitoneală, timp de cinci zile consecutive. Parazitemia a fost calculată prin numărarea eritrocitelor infectate dintre 2000 de eritrocite folosind frotiuri de sânge subțiri colorate cu Giemsa preparate la fiecare două zile până când nu a fost detectat niciun parazit la niciun șoarece. Experimentul a fost repetat de trei ori.
Detectarea PCR și infectivitatea B. microti tratate
După testul de inhibare in vivo, toți șoarecii au fost anesteziați, iar apoi sângele (colectat prin puncție cardiacă), creierul, inima, splina, rinichii și țesuturile hepatice au fost colectate și utilizate pentru extracția ADN-ului. Testul PCR a fost efectuat folosind procedura 6 descrisă mai sus .
1 × 108 eritrocite din grupele I - V au fost transfectate în 5 grupuri noi de șoareci (3/grup) prin injecție intraperitoneală. Parazitemia a fost monitorizată cu frotiuri de sânge subțiri colorate cu Giemsa, pregătite la fiecare trei zile timp de 36 de zile.
Test de inhibiție de două zile și modificări morfologice timpurii și dezvoltarea B. bovis tratat cu CF sau DA
Nouăzeci de microlitri de mediu de cultură GIT conținând CF la 0, 1, 0, 5, 1, 1, 5, 2, 2, 5, 3 și 4 μM sau DA la 0, 01, 0, 05, 0, 1, 0, 25,0, 5, 1 și 2 μM, 0,04% DMSO sau 0,08% M-QW au fost adăugate la o placă de cultură cu 96 de godeuri în triplicat. La fiecare godeu s-au adăugat 10 microlitri de 1% eritrocite parazitate (10% hematocrit) 27,29. Culturile au fost incubate timp de 2 zile și mediul cu medicamente și martori a fost schimbat în zilele 0 și 1 ale culturilor. Valorile IC25, IC50 și IC75 au fost determinate în ziua 2 de cultură la microscop și testul pe bază de fluorescență separat, așa cum este descris mai sus, cu o mică modificare 27, 29. Experimentul a fost repetat de trei ori.
Modificări morfologice ale paraziților B. bovis tratați cu CF sau DA au fost observate la 0, 5, 1, 2, 4, 6, 8, 12, 24, 36 și 48 de ore în pereții RBC prin microscopie. Etapele perechi și unicelulare ale parazitului intraeritrocitar au fost monitorizate în 400 iRBC în colorarea Giemsa. Culturile au fost efectuate în metoda anterioară cu modificări reduse: 900 pl de mediu de cultură GIT conținând CF sau DA la concentrațiile finale de IC25, IC50 și IC75, 0,02% DMSO sau 0,03% M-QW au fost adăugate la placa de cultură cu 24 de godeuri în triplicat. La fiecare godeu s-au adăugat 100 pl de eritrocite parazitate 1% (10% hematocrit). Mediile de cultură cu droguri și controale au fost schimbate la 0 și 24 de ore de cultură.
Test de inhibare de o zi și cuantificarea ARNm și ADN în B. bovis tratat cu CF sau DA
IC 50 și IC 75 CF și DA împotriva B. bovis au fost determinate folosind 8 concentrații diferite din fiecare medicament și martor (0,4% DMSO sau 0,2% M-QW) în triplicat. Nouăzeci de microlitri de mediu de cultură GIT (fără ser) fără medicamente și martori și 10 μl de eritrocite parazitate 1% (10% hematocrit) au fost adăugate la o placă de cultură cu 96 de godeuri în ziua 0 a culturilor, așa cum este descris mai sus, cu puține modificări 27 . În ziua 1, 90 μl de mediu de cultură GIT a fost înlocuit cu mediu de cultură GIT cu CF (la concentrații finale: 0, 5, 1, 2, 3, 4, 10, 20 și 40 μM), DA (la concentrații finale: 0, 1, 1, 2, 4, 6, 8, 10 și 20 μM) sau controale. Valorile IC50 și IC75 au fost determinate în ziua 2 a culturii prin microscopie utilizând colorant RBC colorat cu Giemsa. Experimentul a fost repetat de trei ori.
Pentru a obține ARN și ADN, cultivarea a fost efectuată în conformitate cu un test de inhibare de 1 zi cu 2.000 μl de culturi într-o placă de cultură cu 12 godeuri conținând 1.800 μl mediu de cultură GIT și 200 μl de iRBC. O mie opt sute de microlitri de mediu de cultură GIT a fost înlocuit cu un volum egal de mediu de cultură GIT conținând CF sau DA la IC50 și IC75 sau martori (la concentrații finale: 0,15% DMSO și 0,955% M-QW) în ziua 1 a culturilor. Eritrocitele infectate au fost recoltate în ziua 2 a culturilor.
ARN și ADN au fost extrase fiecare din 200 μl de iRBC cu reactiv TRIzol (Invitrogen, CA, SUA) sau kitul QIAamp DNA Blood Mini (QIAGEN, Tokyo, Japonia) cu digestie RNase A (Takara Bio Inc., Otsu, Japonia) conform la instrucțiunile producătorului. ARN-ul a fost purificat cu un kit QIAamp RNA Isolation Blood Mini (QIAGEN, Tokyo, Japonia) cu digestie recombinantă a DNazei I (Takara Bio Inc., Otsu, Japonia) și apoi a fost supus sintezei ADNc folosind un primer Random Hexamers (Takara Bio Inc., Otsu, Japonia). Japonia). Primerii specifici (Tabelul S2) au fost proiectați folosind nuclei (18S rRNA, tubulină beta lanț și Arm/cat; numere de acces GenBank: L19077, XM_001611566 și respectiv XM_001612062), mitocondriale (cob și cox3; număr de acces GenBank: AB499088) și secvențe de apicoplaste (tufA și clpC; GenBank: NC_011395) utilizând software-ul Primer Express® (Life Technologies, Thermo Fisher Scientific). Testul qPCR a fost efectuat folosind un Master SYBR® Green PCR Master Mix (Applied Biosystems, Warrington, Marea Britanie). Modificările repetate ale genelor țintă comparativ cu ARNr 18S au fost determinate în B. bovis tratate cu CF sau DA și tratate cu DMSO sau M-QW așa cum s-a descris mai sus. .
Analiza statistică și formula ICFIC
Abaterea standard a fost calculată în 3 experimente individuale și o diferență semnificativă statistic (P 1 și 2 și 4 indică antagonism semnificativ, așa cum este descris mai sus 18 .
Estimarea indicelui FIC se bazează pe următoarea formulă:
În qPCR, abaterile standard au fost calculate în cadrul a 3 culturi cultivate independent de grupuri netratate sau tratate și fiecare ciclu a fost duplicat în conformitate cu metoda descrisă anterior și cu principiul analizei statistice 30, 31 .
Mulțumiri
Această lucrare a fost susținută financiar de un grant de cercetare cooperat de la Centrul Național de Cercetare pentru Boli Protozoare, Universitatea Obihiro de Agricultură și Medicină Veterinară (28-joint-4).
Material suplimentar electronic
Informatii suplimentare
Comentarii
Prin trimiterea unui comentariu, sunteți de acord să respectați Termenii și condițiile și Regulile comunității. Dacă considerați că acesta este un act ofensator care nu este conform cu termenii sau liniile directoare, vă rugăm să îl marcați ca fiind inadecvat.
- Bhringaraja Creștere naturală a părului Ayurveda Anti Căderea Părului Medic
- Pronamel Whitening pasta de dinti albitoare 75 ml - Calea naturala spre sanatate
- Denník N luptă împotriva farselor Am zburat deja în redacție, spune editorul - Uneori Nečas
- Exerciții anticelulitice
- Biofreeze pentru dureri musculare, articulare și de spate - DOCTOR FARMACIE
