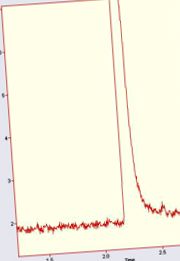
Creșterea raportului semnal-zgomot în cromatografia de gaze
 Necesitățile de laborator de astăzi sunt:
Necesitățile de laborator de astăzi sunt:

- limita inferioară de detectare și cuantificare (LOD, LQD)
- creșterea stabilității sistemelor GC și GC/MS
- inertitate și stabilitate mai ridicate a componentelor GC (coloane, septuri, flacoane, căptușeli etc.)
Se poate realiza o limită inferioară de detectare și cuantificare:
- prin reducerea zgomotului
- prin creșterea semnalului
Selectarea unei septuri adecvate pentru GC
GC Agilent
| Split-splitless | 7890, 6890, 6850, 5890, 5880A | 11 mm |
| Split-splitless | 5880, 5700 | 9,5/10 mm |
| PTV | 7890, 6890, 6850, 5890, 5880A | 11 mm |
| Pe coloană | 7890, 6890, 6850, 5890 | 5 mm |
GC DANI
| Split-splitless | Maestru, GC1000 | 12 mm |
| PTV | Maestru, GC1000 | 12 mm |
GC Perkin-Elmer
| Split-splitless | Auto SYS, Auto SYS XL, 8000, 900, 990, Sigma | 11 mm |
GC Shimadzu
| Split-splitless, PTV | 2010, 2014, 17A | „plug-sept” |
GC Varian
| Coloana împachetată | - | 9,5/10 mm |
| 1079, 1078 | - | 10/11 mm |
| 1177 | - | 9 mm |
| 1075/1077 | - | 11 mm |
GC Thermo Scientific
| Split-splitless | Trace, 8000, 8000 TOP | 17 mm |
| PTV | 8000 | 17 mm |
| Split-splitless | Trace, GC9001 | 9,5 mm |
Microseringuri
Curățarea și întreținerea la microscop
Seringile cromatografice sunt dozatoare foarte precise și de înaltă calitate de cantități de microlitri de lichide. Cu toate acestea, acestea sunt produse care trebuie să fie bine îngrijite. Acest lucru le va asigura o durată lungă de viață și va îmbunătăți dozarea probelor pentru cromatografie.
Unii solvenți, cum ar fi hidrocarburi halogenate, pot deteriora adezivul foarte rezistent (piese cimentate) care fixează acul pe corpul microsiringei. Acest lucru poate duce la rigidizarea pistonului sau înfundarea acului.
Curățarea corpului sticlei seringii
Seringile Hamilton și SGE se curăță cel mai bine cu un solvent de solubilitate cunoscută pentru a elimina cel mai bine reziduurile probei. Când curățați, preferați solvenții care nu conțin compuși alcalini, fosfați sau detergenți. Hamilton oferă soluție de curățare biodegradabilă (numărul de catalog 18311).
Clătiți seringa (interiorul corpului de sticlă) mai întâi cu apă deionizată, acetonă sau alt solvent solubil în apă (de exemplu, metanol). Apoi clătiți seringa cu hexan și uscați-o. Evitați scufundarea seringii în soluția de curățare mult timp.
Seringi MICROLITER ™ (seriile 600, 700, 800 și 900)
- Clătiți seringa cu solventul care dizolvă cel mai bine reziduurile probei.
- Scoateți pistonul din corpul seringii și ștergeți-l ușor cu o cârpă fără scame (este ideal să înmuiați cârpa în solventul ales). Introduceți pistonul înapoi în corpul seringii și extrageți/scurgeți apa deionizată de mai multe ori succesiv. Repetați procedura cu acetonă sau metanol și, în final, hexan sau un solvent similar nepolar.
- Uscați seringa.
- Dacă lucrați cu o soluție de sare, vă recomandăm să păstrați seringa cu pistonul scos.
Seringi GASTIGHT® (seriile 1000, 1700 și 1800)
- Clătiți seringa cu solventul care dizolvă cel mai bine reziduurile probei.
- Scoateți pistonul din corpul seringii și ștergeți-l ușor cu o cârpă fără scame (este ideal să înmuiați cârpa în solventul ales). Introduceți pistonul înapoi în corpul seringii și extrageți/scurgeți apa deionizată de mai multe ori succesiv. Repetați procedura cu acetonă sau metanol și, în final, hexan sau un solvent similar nepolar.
- Uscați seringa.
- Dacă lucrați cu soluții de sare, vă recomandăm să păstrați seringa cu pistonul scos.
Depozitarea seringii
Vă recomandăm să păstrați seringile în ambalajul lor original. Protejează perfect și, de asemenea, vă oferă informații despre tipul de seringă.
Desorbția termică
În această secțiune, am pregătit informații importante pentru dvs. atunci când lucrați cu desorbția termică. Aceasta este o tehnică analitică relativ solicitantă, pentru care aceste informații vă vor ușura munca. Dacă nu găsiți informațiile pe care le căutați, contactați specialiștii noștri.
Măsurarea emisiilor de materiale
Coloane și solvenți ChromShell
Când se utilizează coloane ChromShell HPLC, este important să se țină seama de câteva caracteristici importante ale solvenților organici utilizați în faza mobilă. Vâscozitatea este cel mai important parametru, deoarece solvenții cu vâscozitate ridicată determină o creștere a contrapresiunii în sistemul HPLC. Alți parametri importanți sunt „limita UV”, indicele de polaritate și prețul. Solvenții cu un parametru ridicat de „tăiere UV” afectează sensibilitatea în detectoarele UV/VIS și solvenții cu polaritate scăzută determină eluarea mai rapidă a compușilor organici și sunt adesea utilizați pentru curățarea sau regenerarea coloanelor.
Acetonitril
este probabil cel mai bun solvent organic utilizat într-un amestec cu apă, deoarece asigură cea mai mică contrapresiune în sistemele HPLC. În același timp, are o „tăiere UV” foarte scăzută și, prin urmare, o sensibilitate excelentă în detectoarele UV/Vis. Cel mai mare dezavantaj este prețul său, care a crescut semnificativ recent.
Metanol
este un alt solvent foarte popular care are o putere de eluție similară cu acetonitrilul, are o absorbanță relativ scăzută în domeniul UV și este mult mai ieftin decât acetonitrilul. Principalul dezavantaj al metanolului atunci când este utilizat cu coloane HPLC cu o dimensiune mică a particulelor este crearea unei contrapresiuni mai mari, care poate depăși limita instrumentului HPLC.
Acetonă
este un solvent mai puțin utilizat datorită absorbției ridicate în domeniul UV. Este uneori utilizat în analize ale compușilor care se absorb la lungimi de undă mai mari sau împreună cu alte tipuri de detectoare, de ex. DOMNIȘOARĂ.
Etanol
nu este recomandat în mod normal pentru utilizare cu HPLC. Când este amestecat cu apă, provoacă o contrapresiune ridicată.
Iso-, N-propanol
au o forță de eluție relativ puternică și sunt folosite în cea mai mare parte pentru curățarea coloanelor la debituri mici, deoarece generează, de asemenea, o contrapresiune mare.
Tetrahidrofuran
are o putere de eluție similară cu n-propanolul, dar datorită prețului mai ridicat, este folosit mai rar.
Dezactivarea sticlei
Dezactivarea sticlei de către DMDCS
Dimetildiclorosilanul (DMDCS) reacționează cu grupările hidroxil active prezente pe suprafața sticlei pentru a forma o suprafață dezactivată. Această procedură prevede recipiente de sticlă inerte concepute în principal pentru compuși sensibili.
Abordare
În timpul dezactivării, clorura de hidrogen (HCl) este evoluată, deci dezactivarea trebuie efectuată într-o hotă de fum.
- Utilizați o soluție de 5% DMDCS în toluen pentru a dezactiva. Puteți pregăti soluția dizolvând 20 ml de DMDCS în 400 ml de toluen. Păstrați soluția într-un recipient din sticlă întunecată la temperatura camerei.
- Scufundați vasul de sticlă care trebuie dezactivat în soluție de 5% DMDCS timp de 15 până la 30 de minute.
- Clătiți paharul de două ori cu toluen.
- Scufundați paharul în metanol timp de 15 minute.
- Clătiți paharul cu metanol.
- Uscați paharul cu azot pur (fără umezeală și hidrocarburi).
Setarea vitezei liniare
Viteza liniară este un parametru important în cromatografie, care are o mare influență asupra eficienței separării, deci este importantă în dezvoltarea metodelor de determinare a volumului și a timpului mort.
Măsurarea vitezei liniare în GC
Timpul mort este determinat prin injectarea a 2 μl de compus, care nu are retenție pe coloana cromatografică și este detectat cu ajutorul unui detector. Folosind o seringă etanșă la gaze, extrageți faza gazoasă sau gazoasă a compusului și distribuiți-o în cromatograf. Măsurați cu precizie timpul de injecție și timpul de eluare din care se determină timpul mort.
| FID | metan, propan, butan |
| ECD | clorometan, aer (la temperatura scăzută a termostatului) |
| TCD | metan, butan, aer (la temperatura scăzută a termostatului) |
| NPD | acetonitril, aer (la temperatura scăzută a termostatului) |
| DOMNIȘOARĂ | propan, butan, argon, aer (la temperatura scăzută a termostatului) |
| PID | acetilenă, etilenă |
Notă: Unii compuși pot avea o ușoară retenție pe coloanele cu folie groasă, dar acest lucru este reproductibil pentru tipuri similare de coloane.
Utilizarea coloanelor chirale
Știți cum să utilizați corect coloanele chirale pe bază de celuloză?
Coloanele LUX sunt transportate în n-hexan/2-propanol (9: 1, v/v). Fiecare coloană este testată individual și are întotdeauna un certificat de calitate cu parametri de separare pentru determinarea oxidului trans-stilbenic.
Utilizarea fazelor mobile
Coloanele Lux pot fi utilizate ca în fază normală (amestecuri de n-alcani/alcooli), în fază inversă (amestecuri de apă/MeOH, apă/ACN și tampon/MeOH și tampon/ACN) sau în solvenți organici polari (100% ACN, alcooli inferiori și amestecurile lor).
Compatibilitate fază mobilă
La schimbarea fazei mobile, este întotdeauna necesar să urmați procedura stabilită pentru spălarea coloanelor. Este întotdeauna necesar să se evalueze miscibilitatea solvenților individuali utilizați. Pentru a transfera în siguranță coloana din hexan în metanol (ACN) și invers, utilizați întotdeauna 100% 2-propanol ca solvent de transport la un debit de 0,2 - 0,5 ml/min. Pentru a elimina în mod fiabil faza mobilă originală, clătiți coloana cu aproximativ 10 ori volumul coloanei (adică 25 ml de 2-propanol 100% pentru o coloană de 250 x 4,6 mm, 15 ml pentru 150 x 4,6 mm). Mai mult, dacă se utilizează tampon nemiscibil cu 2-propanol, clătiți coloana cu 100% apă înainte și după utilizarea acestui tampon.
Utilizarea modificatoarelor de fază mobile
Pentru unele substanțe chirale acide sau bazice, este necesar să se utilizeze modificatori specifici MF pentru a se obține separarea chirală corectă sau forma dorită a vârfurilor. Dietilamina, etanolamina sau butilamina în concentrații de 0,1-0,5% pot fi utilizate pentru probele bazice, în timp ce acidul acetic sau trifluoroacetic este de obicei utilizat în concentrații de 0,1-0,2% pentru probele acide. Sunt posibile și amestecuri de aditivi bazici și acizi, de ex. acetat de dietilamină sau trifluoroacetat. Coloanele Lux dau aceleași rezultate folosind toți solvenții de mai sus și modificatorii MF la concentrațiile indicate.
Solvenți incompatibili
Coloanele chirale Lux sunt realizate prin legarea diferiților derivați polizaharidici pe o suprafață de silicagel. Toți solvenții care dizolvă derivații polizaharidici nu trebuie să intre în contact cu faza staționară, chiar și în orice concentrație, de ex. THF, acetonă, hidrocarburi clorurate, acetat de etil, dimetil sulfoxid, DMF, N-metilformamidă și altele asemenea.
Limita de presiune
Debitul de fază mobilă trebuie setat astfel încât contrapresiunea să nu depășească 300 bari (4300 psi).
Temperatura de lucru
Folosind faze mobile standard (cum ar fi N-alcani/alcooli), intervalul de temperatură al coloanelor Lux este de 0-50 ° C.
Stocarea coloanei
Pentru depozitare mai lungă, se recomandă stocarea coloanelor Lux în n-hexan/2-propanol (9: 1, v/v). Coloanele utilizate în MF invers trebuie spălate mai întâi cu apă (ori de câte ori tamponul a fost utilizat ca modificator MF invers) și apoi cu metanol și/sau metanol numai dacă nu a fost utilizat tampon. Coloana poate fi, de asemenea, stocată în metanol.
Prelungirea duratei de viață a coloanei Lux
Chromservis recomandă utilizarea sistemului universal de protecție a coloanelor Security Guard și a precolonelor corespunzătoare pentru a asigura o separare pe termen lung și fără probleme pe coloanele Lux, în special pentru separarea probelor obținute din matrici complexe și complexe. În mod optim, proba trebuie dizolvată complet în MF corespunzător și apoi filtrată printr-un filtru de seringă cu o porozitate de 0,45 μm.
Sugestii și sfaturi
Această pagină conține informații tehnice, sfaturi și sfaturi pentru decizia dvs. și recomandări atunci când alegeți un accesoriu cromatografic.
Spațiul dinamic dinamic
Metoda spațiului dinamic dinamic (DHS) este utilizată pentru o gamă largă de aplicații de mediu. Cea mai mare utilizare a acestuia este în analiza compușilor organici volatili (COV) în apă potabilă, subterană, de suprafață și ape uzate. Aceste matrice conțin un amestec de compuși cu polaritate și volatilitate diferite (hidrocarburi clorurate, hidrocarburi aromatice, compuși oxigenați etc.). Spațiul dinamic dinamic este, de asemenea, utilizat pentru următoarele aplicații:
- caracterizarea condimentelor, plantelor, alimentelor, săpunurilor și parfumurilor
- determinarea monomerilor reziduali și a COV în polimeri
- analiza solvenților reziduali din ambalajele alimentare și produsele farmaceutice
- verificarea „alimentelor organice”
- analiza urmelor de ingrediente farmaceutice active
- analiza metaboliților din fluidele biologice (hidrocarburi aromatice în urină, benzen în sânge)
- Sfaturi, sfaturi și trucuri despre cum să vă îngrijiți pielea sau digestia
- Mâncarea potrivită pentru pisicile adulte - sfaturi și sfaturi pentru crescători
- Sfaturi, sfaturi, experiențe ale unui bărbat care a slăbit 40 de kilograme în peste un an
- Rețete, tutoriale, idei, bricolaj, sfaturi, trucuri, sfaturi
- Sfaturi și sfaturi pentru slăbit; Viață confortabilă
