obiecte
abstract
Scopul acestui studiu a fost de a determina relația doză-răspuns pentru mortalitate și deformare în etapele timpurii ale vieții peștilor zebră după microinjecția embrionilor cu doză gradată de SeMet și de a investiga potențialul mecanism (e) de bază al toxicității dezvoltării indusă de Se Utilizarea peștilor zebră pentru studii de toxicologie a dezvoltării și de manipulare a embrionilor are multe avantaje. Peștele zebră produce embrioni transparenți și neaderenți care ajută la microinjecția cu succes a substanțelor chimice 26, 27, 28. Având în vedere informațiile extinse disponibile despre biologia dezvoltării și genomul peștilor zebră, studiile toxicologice asupra dezvoltării pot fi efectuate cu ușurință pe această specie de pești 27, 28 .
Rezultatul
Concentrațiile de seleniu
Concentrațiile măsurate și nominale de Se au fost direct proporționale cu fiecare grup de tratament. Concentrațiile măsurate de Se în grupurile microinjectate de control, 8, 16 sau 32 ug Se/g greutate uscată (dm) au fost de 1,6 ± 0, 1, 11, 0 ± 0, 6, 18, 7 ± 1, 0 și 29,3. ± 0,5 ug Se/g dm, respectiv. Concentrații semnificativ mai mari de Se au fost observate la ouă microinjectate cu 8, 16 sau 32 ug Se/g dm comparativ cu ouă microinjectate cu soluție (control) Danieau fără ser (control) (p 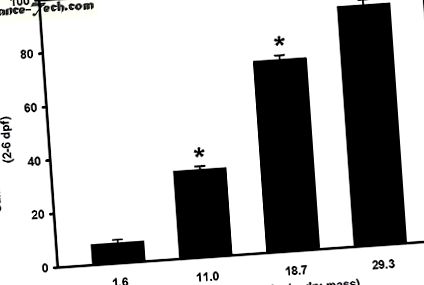
* Diferență semnificativă în comparație cu grupul de control folosind ANOVA unidirecțional, urmată de testul lui Dunnett (p
* Diferență semnificativă în comparație cu grupul de control folosind ANOVA unidirecțional, urmată de testul lui Dunnett (p
O poză A prezintă un pește normal (de control), B prezintă cifoză și lordoză, C prezintă edem, D prezintă scolioză, E prezintă deformări ale aripilor și F este un pește larvar cu deformări multiple și edem pericardic.
Imagine la dimensiune completă
Efectele expunerii la reacții antioxidante
Transcrierile în exces nrf2a și nrf2b, glutation peroxidaza 1a (gpx1a), glutation S-transferază pi 1 și 2 (gstp1 și gstp2), receptorul hidrocarbonat arii 2 (ahr2) și proteina tirozin fosfatază 1b (ptp1b) au fost determinate la 48, 72 și 96 ore după fertilizare (HPF) în larvele de pește zebră de la lotul martor și 10 ug grupuri de microinjecție Se/g dm. Reglarea în sus a nrf2a și nrf2b a fost observată la 72 și 96 hpf la peștele zebră din grupul expus la SeMet comparativ cu grupul martor (Fig. 4A, B). O reglare semnificativ mai mare a transcrierii nrf2a în exces a fost observată la 96 hpf, în timp ce numărul transcrierilor nrf2b a crescut semnificativ atât la 72 cât și la 96 hpf (p
Transcrierea în exces a factorului 2a (nrf2a), ( B ) nrf2b, ( C ) glutation S-transferaza pi1 (gstp1), ( D ) gstp2, ( E ) receptorul de hidrocarbură arii 2 (ahr2), ( B ) nrf2b, ( C ) gstp2, ( E ) receptorul hidrocarburii arii 2 (ahr2)) și ( F ) proteină tirozin fosfatază 1B (ptp1b) la peștele zebră expus fie la 10 μg Se/g dm sub formă de selenometionină sau soluție de control (Danieau) prin microinjecție embrionară. Excesul de transcriere a fost determinat prin PCR cantitativă în timp real 48, 72 și 96 de ore după fertilizare (hpf). * În mod semnificativ diferit de grupul de control folosind testul t student (p
Transcriere în exces ( A ) metionină adenosiltransferază 1a (mat1a); A ( B ) mat2ab în pește zebră expus fie la 10 μg Se/g dm ca selenometionină sau soluție de control (Danieau) prin microinjecție embrionară. Excesul de transcriere a fost determinat prin PCR cantitativă în timp real 48, 72 și 96 de ore după fertilizare (hpf). * În mod semnificativ diferit de grupul de control care utilizează testul t student (p 2, 3, 29). În acest studiu, s-au înregistrat reduceri semnificative ale incubatorului de embrioni, creșteri ale mortalității și deformărilor dependente de doză și abundențe modificate ale transcrierilor nrf2a, nrf2b, gstp2, ahr2, ptp1b, mat1a și mat2ab, în etapele incipiente ale vieții. au fost relevante din punct de vedere ecologic în acest studiu și astfel de concentrații au fost înregistrate în ouăle de pești colectate din ecosistemele acvatice contaminate cu Se.11, 29, 29, 30 .
Există un echilibru între activitățile protein tirozin kinazelor (PTK) și protein tirozin fosfatazelor (PTP) în celule, care joacă un rol cheie în semnalizarea celulară și dezvoltarea animalelor 42, 43, 44. S-a demonstrat că stresul oxidativ și expunerea la substanțe chimice, inclusiv SeMet, inhibă abundența transcriptului și/sau activitatea proteinei tirozin fosfatazei 1B in vitro și in vivo 25, 42, 45, 46. Studiile anterioare au demonstrat rolul ptp1b în aderența celulelor celulare, angiogeneza, apoptoza și migrația celulară 43, 47, 48, procese critice în dezvoltarea embrionilor vertebrate. Prin urmare, am examinat numărul de transcrieri ptp1b în stadiile incipiente ale vieții peștilor zebră după expunerea dezvoltării la excesul de SeMet prin microinjecție de ou și am observat că SeMet a cauzat o abundență semnificativ reglementată în jos a transcriptului ptp1b la 48 CPF. Această constatare sugerează că modificarea activității proteinelor tirozin fosfatazei poate fi, de asemenea, implicată în toxicitatea dezvoltării indusă de ser la peștele zebră.
În concluzie, rezultatele noastre sugerează că depozitarea unor concentrații mai mari de formă liberă de SeMet în ouă provoacă preferențial mortalitatea, mai degrabă decât deformarea în primele etape ale vieții peștilor. Expunerea la dezvoltare a excesului de SeMet prin microinjecție embrionară a modificat expresia genică a factorilor de transcripție care răspund la oxidant, nrf2a și nrf2b, precum și gstp1, gstp2, ptplb, ahr2, matla și mat2ab. Aceste rezultate indică faptul că toxicitatea dezvoltării în exces a peștilor zebra expuși la SeMet s-ar putea datora stresului oxidativ sau metilării afectate sau unei combinații a acestor mecanisme. În cele din urmă, studiul nostru arată că tehnicile de microinjecție a embrionilor pot fi utilizate cu succes pentru a investiga mecanismele de toxicitate a substanțelor chimice teratogene în etapele timpurii ale vieții peștilor zebră.
metode
Compusul testat
Seleno-L-metionina a fost cumpărată de la Sigma-Aldrich (Oakville, ON, Canada). Puritatea compusului a fost mai mare de 98%.
Test animal
Toate procedurile de adăpostire a peștilor și procedurile experimentale adoptate în acest studiu au fost aprobate de Consiliul etic pentru cercetarea animalelor de la Universitatea din Saskatchewan (Protocolul nr. 20030076) și au aderat la orientările Consiliului canadian pentru îngrijirea animalelor de uz uman la animale . Un pește zebraf adult de tip sălbatic (tulpina AB; aproximativ 4-5 luni) a fost achiziționat de la un furnizor local și plasat într-o cameră de temperatură controlată de mediu (28,0 ± 1,0 ° C) și o fotoperioadă (lumină timp de 14 ore și 10 ore întuneric ).). Greutatea corporală medie umedă a peștilor a fost de 0,366 ± 0,019 g. Peștii adulți au fost aclimatizați la condițiile de laborator cu 4 săptămâni înainte de reproducere. În timpul perioadei de aclimatizare, peștii au fost hrăniți cu hrană de bază Nutrafin® fulgi (Hagen Inc., Montreal, QC, Canada) și chiromi purificați (viermi de sânge bio-puri, Hikari Sales Inc., Hayward, CA, SUA).
microinjectii
În plus, a fost cauzată concentrația de ouă Se, provocând mortalitate cu 20% (
10 μg Se/g dm), iar această doză a fost injectată în gălbenuș pentru a determina cantitatea de ARNm genici sensibili la oxidant (nrf2a, nrf2b, gpx1a, gstp1 și gstp2). ), enzime implicate în catabolismul metioninei (mat1a, mat2a, mat2aa și mat2ab), ahr2 și ptp1b la 48, 72 și 96 hpf zebrafish.
Analiza deformării
Analiza tulpinii totale a fost efectuată pe peștele zebră larvar de 6 dpf. Procedura detaliată pentru analiza deformării a fost explicată anterior. Pe scurt, larvele de pește zebră au fost eutanasiate printr-o supradoză de metansulfonat de tricaină tamponată (MS-222) (Sigma-Aldrich, Oakville, ON, Canada) și conservate în 10% formalină tamponată timp de 12 ore înainte de a fi transferate la 70% etanol. Fiecare larvă a larvelor a fost examinată pentru a determina deformarea și edemul scheletului, craniofacial și al coastei utilizând un model de microscop de disecție Olympus SZ-CTV (Olympus, Melville, NY, SUA) și a fost înregistrată prezența sau absența anomaliilor de dezvoltare pentru fiecare pește. Procentul total de deformări a fost calculat prin împărțirea numărului de pești larvați malformați la numărul total de pești larvați și înmulțirea cu 100.
Cuantificarea seleniului
Concentrațiile totale de Se în probe de ouă combinate au fost măsurate prin spectrometrie de masă cuplată inductiv (ICP-MS) la Centrul de Toxicologie (Universitatea din Saskatchewan, Saskatoon, SK, Canada). Din fiecare grup de tratament, s-au colectat n = 3 până la 4 replici de 45 până la 50 de ouă colectate pentru cuantificarea Se. O procedură detaliată pentru analiza Se a fost descrisă anterior 3, 59. Limita de cuantificare (LOQ) de 0,13 μg Se/g a fost determinată folosind metodele libere. Concentrațiile de se în ouă au fost măsurate pe bază umedă și transformate în greutate uscată pe baza unui conținut de umiditate de 92,5% determinat într-un subset de ouă de zebră.
Reacție în lanț în timp real (Q-PCR)
Expresia MRNA pentru gene care codifică enzime sau factori de interes de transcripție a fost cuantificată utilizând reacția în lanț cantitativă a polimerazei (Q-PCR). ARN-ul total a fost extras din n = 3-5 replici a 20 de embrioni și/sau larve de pește zebră din fiecare grup de tratament folosind Mini-kitul RNeasy Lipid Tissue (Qiagen, Mississauga, ON, Canada) conform instrucțiunilor producătorului. ARN-ul total purificat a fost cuantificat utilizând un spectrofotometru NanoDrop ND-1000 (NanoDrop Technologies, Wilmington, DE, SUA). Trusa de transcriere inversă QuantiTect® (Qiagen) a fost utilizată pentru a sintetiza ADNc din 1 μg de ARN total. Procedurile detaliate pentru extracția ARN și sinteza ADNc au fost explicate în altă parte 25 .
PCR cantitativă în timp real a fost efectuată pe plăci de PCR cu 96 de godeuri utilizând un sistem de PCR în timp real ABI 7300 (Applied Biosystems, Foster City, CA, SUA). Primerii specifici genei au fost proiectați împotriva genelor țintă utilizând software-ul Primer 3 și au fost prezentate secvențe de primer (Tabelul 2). Procedurile detaliate Q-PCR au fost explicate în altă parte 25. Apariția genei țintă a transcrierii a fost cuantificată prin normalizare pentru expresia factorului de alungire 1a (ef1α) conform metodei EMN (Media Normalized Expression Media) conform Simon (2003) 60 .
Tabel în dimensiune completă
analize statistice
Toate analizele statistice au fost efectuate folosind Sigmaplot 11 (Systat Software Inc., San Jose, CA, SUA). Datele au fost testate pentru normalitate folosind testul Shapiro-Wilk și pentru omogenitatea împrăștierii folosind testul Levene. Datele care nu îndeplineau cerințele pentru procedurile statistice parametrice au fost transformate în log 10. Datele netransformate sunt prezentate în toate figurile. Diferențe semnificative în concentrațiile totale de Se în ouă, incubație de embrioni și mortalitate și deformări generale ale vieții timpurii a peștilor zebră de la grupele de control și de microinjecție SeMet clasificate au fost testate prin ANOVA unidirecțional, urmat de testul Dunnett. Transcrierile în exces ale genelor de antioxidanți, metilare, AhR și proteine fosfatază legate de activitatea peștilor zebră din grupul martor și grupuri de 10 μg injectate cu Se/g dm la 48, 72 și 96 hpf au fost testate folosind un test t student. Datele au fost exprimate ca medie ± Diferențele SEM au fost considerate semnificative statistic la p
