abstract
Principalul
Dovezi recente sugerează că citokinele inflamatorii joacă un rol în patogeneza NE. Nivelurile crescute de IL-6 și IL-8 în lichidul cefalorahidian la nou-născuții la termen s-au corelat cu encefalopatia mai severă (1). La nou-născuții născuți de mame cu corioamnionită clinică, cele mai ridicate niveluri de IL-6, IL-8 și RANTES au fost măsurate la nou-născuții care aveau NE și/sau convulsii (2). Răspunsul inflamator neonatal poate afecta, de asemenea, rezultatul dezvoltării neurologice, deoarece citokinele crescute la nou-născuții cu NE se corelează cu un rezultat timpuriu (1). Citokinele serice neonatale (IL-1, IL-8, IL-9, TNF-α și RANTES) au fost, de asemenea, semnificativ mai mari la copiii care au dezvoltat ulterior paralizie cerebrală (CP) (3, 4).
Cu toate acestea, nu a fost stabilită asocierea citokinelor cu metabolismul creierului neonatal, leziunile cerebrale și rezultatele cognitive și motorii pe termen lung la NE. Scopul acestui studiu de cohortă a fost de a determina dacă nivelurile de citokine serice neonatale sunt asociate cu 1) rate ale metabolismului creierului, evaluate de 1H-MRS, 2) anomalii în concordanță cu deteriorarea creierului RMN și 3) rezultate neurologice ale dezvoltării evaluate prin metode de dezvoltare și neuromotorii . evaluare timp de 30 de luni.
metode
Subiecte.
Această cohortă a fost derivată dintr-un studiu prospectiv pentru a determina predictorii dezvoltării neurologice a RMN la nou-născuți cu risc pe termen lung și pe termen scurt de NE. Ulterior, nou-născuții admiși la creșa de terapie intensivă la UCSF și la un spital regional asociat au fost examinați între octombrie 1993 și ianuarie 2000 pentru a înscrie 125 de nou-născuți cu cel puțin unul dintre următoarele: 1) artera ombilicală cu pH 10; 3) Scorul Apgar ≤ 5 la 5 minute de viață; sau 4) NO aparent, evaluat de un neonatolog (Fig. 1). Nou-născuții au fost excluși dacă vârsta lor gestațională a fost 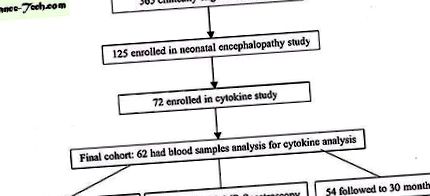
Organigramă care ilustrează formarea cohortei.
Imagine la dimensiune completă
Citokine.
Stare neonatală.
Revizuirea studiului clinic a inclus informații relevante pentru analiza nivelurilor de citokine: infecție placentară sau neonatală, transfuzie de sânge neonatală, ECMO sau tratament cu steroizi materni și scoruri pentru fiziologie acută neonatală - mărire perinatală (SNAP-PE) ca măsură generală a bolii sistemice severitate în primele 24 de ore de admitere.
Date de rezonanță magnetică.
Dintre cei 62 de nou-născuți din studiul citokinelor, 61 au fost studiați cu RMN cerebral; Un nou-născut a fost clinic instabil pentru imagistică. Dintre acești 61 de nou-născuți, s-au efectuat și 42 H-MRS (1 H-MRS a fost inclus în protocolul de studiu în 1995) (Fig. 1). Același scaner MR și tehnici au fost utilizate pentru întreaga cohortă. Nou-născuții au fost imaginați la o viață mediană de 6 d (interval 2-16 d) odată ce au fost stabili din punct de vedere clinic pentru transmiterea sigură la un scaner MR și timpul de imagistică a fost disponibil.
RMN cerebral la toți nou-născuții a inclus ecouri de spin sagital și axial de 4 mm (timp de repetare 500/11/2 (TR)/timp de ecou (TE)/excitație) și ecouri de spin axial de 4 mm (spațiu de 2 mm) 3000/60, 120/1) creier întreg. Anomaliile RMN ale secvențelor ponderate T1 și T2 au fost evaluate utilizând sistemul descris mai sus pentru a determina rezultatul neuromotor (6) în DGN după cum urmează: 0 = DGN normal sau focar izolat al infarctului cortical; 1 = semnal anormal în talamus; 2 = semnal anormal în talamus și nucleul lentiformului; 3 = semnal anormal în talamus, nucleul lentiform și cortexul perirolandic; și 4 = conexiune mai largă. Rezultatele din WS au fost evaluate după cum urmează: 0 = WS normal; 1 = infarct focal unic; 2 = semnal anormal în partea din față sau din spate a substanței albe; 3 = semnal anormal în partea anterioară sau posterioară a cortexului cerebral și a substanței albe; 4 = semnal anormal în zonele din față și din spate ale bazinului hidrografic; și 5 = afectare corticală mai extinsă. Scorurile maxime în ambele secvențe pentru ambele regiuni au fost utilizate pentru analiză.
1 H-MRS poate fi utilizat pentru a detecta o creștere a nivelului de lactat (lactat/colină), indicând o metabolizare afectată a procesului oxidativ al creierului și o scădere a nivelurilor de NAA (NAA/colină), indicând maturarea întârziată a celulelor, deteriorarea celulelor, disfuncție sau moarte (7). Spectrele de protoni au fost obținute din DGN și zona frontală a bazinului (5 cm 3 voxeli) (Fig. 2), deoarece aceste regiuni sunt deosebit de predispuse la leziuni neonatale (8). 1 H-MRS a fost efectuat folosind o tehnică de spectroscopie cu rezoluție spot (PRESS) pentru a obține spectre de lungă durată cu un ecou PROBE (PROton Brain Exam; General Electric Medical Systems, Milwaukee, WI) secvență în 5 minute cu TR = 2 s, TE = 288 ms și un total de 128 achiziții așa cum este descris mai sus (9). După achiziție, datele 1H-MRS au fost transferate offline și analizate pe o stație de lucru SPARC (Sun Microsystems, Mountain View, CA). Datele 1 H-MRS au fost transformata Fourier și linia de bază. Suprafețele de vârf au fost integrate pentru rezonanța colinei, creatinei, NAA și lactatului.
(A) Localizarea voxelilor 1H-MRS se suprapune peste imaginile RM cerebrale axiale T2 ale termenului neonat (casetă). Voxel DGN conține nucleii lentiformi, talamusul ventrolateral și membrul posterior al capsulei interioare. Voxel WS cuprinde în principal o substanță albă subcorticală în zona dintre distribuția arterei cerebrale anterioare și artera cerebrală mijlocie. (B) Spectre reprezentative de protoni la un nou-născut cu dezvoltare neurologică normală (voxeli, așa cum se arată, tehnici PRESS TR 2 s, TE 288 ms și 128 achiziții). Rețineți absența vârfului lactat și, de asemenea, că amplitudinea vârfului NAA este între golurile vârfurilor colinei (Cho) și creatinei (Cre). (C) Spectre reprezentative ale protonului unui nou-născut cu dezvoltare neurologică anormală (voxeli, după cum se arată, tehnici PRESS TR 2 s, TE 288 ms și 128 achiziții). Rețineți prezența dubletului lactat și scăderea relativă a vârfului NAA în comparație cu spectrul din B.
Imagine la dimensiune completă
Examinări de dezvoltare.
Neurologi pediatrici orbiți de informațiile neonatale atribuite de NMS în examinările standardizate: 0 = normal; 1 = ton sau reflexe anormale sau reflexe primitive; 2 = tonus și reflexe anormale; 3 = anomalie a puterii și tonului scăzut; 4 = afectarea nervului cranian și orice anomalie motorie; 5 = afectarea nervului cranian și cvadripareza spastică; și 6 = moarte (10). Dezvoltarea cognitivă a fost înregistrată în mod satisfăcător pentru fiecare copil folosind testul Scala Bayley MDI pentru dezvoltarea copilului II (11). Rezultatele neurodezvoltării la douăsprezece luni (n = 60) și 30 de luni (n = 54) au fost clasificate a priori ca funcțional normale dacă MDI> 70 și scorurile neuromotorii 0,5 (5). Deși nu au putut fi plasate probe de sânge pentru cei 10 nou-născuți înscriși în studiul cu citokine, acești nou-născuți au avut o distribuție similară a leziunilor la RMN comparativ cu cei 62 de nou-născuți ale căror puncte de sânge au fost analizate (toți p> 0,2).
Caracteristicile sugarilor și mamelor.
Citokine.
Sângele a fost colectat pentru analiza citokinelor la o medie de 2d din viață (interval 1-8 d). Un singur nou-născut a avut sânge extras după 8 zile (zi 17); îndepărtarea acestui nou-născut nu a modificat rezultatele analizelor ulterioare. Concentrațiile de citokine nu s-au corelat cu ziua vieții la care s-a recoltat sânge (p> 0, 1). Nivelurile de citokine la 12 nou-născuți care au primit transfuzii de sânge înainte de obținerea probelor de călcâi nu au fost semnificativ diferite de cele măsurate în restul cohortei (p> 0,6). În plus față de IL-13, citokinele s-au corelat semnificativ între ele (Tabelul 1).
Tabel în dimensiune completă
Date MR.
Lactatul/colina a fost semnificativ crescut cu IL-1β, IL-6, IL-8 și TNF-α în DGN, dar nu în zona WS, ajustând ziua colectării sângelui și efectuând MR (Tabelul 2). ). Asocierea a rămas semnificativă fără modificări (Fig. 3). IL-9, IL-12 și IL-13 nu au fost asociate cu lactat/colină în nicio regiune. Citokinele măsurate nu au fost asociate cu NAA/colină (Tabelul 2). În mod similar, nivelurile de citokine nu au fost asociate cu scorurile structurale RMN (toate p> 0,05). Cu toate acestea, scorurile structurale RMN au fost corelate semnificativ cu lactatul/colina și NAA/colina în fiecare zonă respectivă (p
Asocierea dintre citokinele serice neonatale și lactatul/colina cerebrală din DGN. Într-o analiză cu o singură coadă, lactatul/colina a crescut cu IL-1β (p = 0,05), IL-6 (p = 0,007), IL-8 (p = 0,01) și TNF-α (p = 0, 01). Zonele hașurate reprezintă un interval de încredere de 95%.
Imagine la dimensiune completă
Neurodezvoltare.
Dintre cei 54 de copii cu dezvoltare neurologică la 30 de luni, 20 au avut un rezultat anormal (Tabelul 3): 3 au murit din cauza complicațiilor din NE înainte de a atinge vârsta de 6 luni, 4 au avut insuficiență cognitivă izolată (MDI 80 în total; = 3 din trei și SMN = 5 la doi copii) și 8 au avut anomalii cognitive și motorii mixte (MDI total ≤ 50; SMN = 3 la unul, SMN = 5 la șapte). Din cei 8 copii pierduți la urmărire la vârsta de 30 de ani, 5 au prezentat o dezvoltare neurologică normală și 1 anormală în studiul de 12 luni și 2 nu au fost evaluați. În general, a existat o scădere a valorilor medii ale MDI de la 12 la 30 de luni, dar nu de la scorurile neuromotorii medii (Tabelul 4). Mai exact, șapte copii cu un rezultat normal la 12 luni au scăzut în afecțiune: trei aveau un motor izolat și patru aveau anomalii cognitive izolate după 30 de luni. Doi copii cu deteriorări motorii izolate după 12 luni nu au prezentat nicio deteriorare după 30 de luni. Dintre cei 10 copii cu anomalii mixte la 12 luni, 1 avea funcție cognitivă izolată, 1 avea insuficiență motorie izolată și 8 aveau încă anomalii mixte la 30 de luni. Niciunul dintre copiii cu anomalii mixte la vârsta de 12 luni nu a fost diagnosticat ulterior ca fiind normal.
Tabel în dimensiune completă
Tabel în dimensiune completă
Copiii cu un rezultat anormal de 30 de ori au avut un NE mai sever și au fost mai predispuși să aibă crize neonatale și o operație cezariană decât copiii cu un rezultat normal (Tabelul 3).
Un nou-născut cu sepsis neonatal dovedit a avut un rezultat anormal. Nivelurile sale de citokine au fost în intervalul inferior al grupului de rezultate anormale, iar eliminarea sa din analiză nu a modificat rezultatele.
Nivelurile neonatale de IL-1β, IL-6 și IL-8 au fost semnificativ mai mari la copii cu un rezultat anormal la 30 de luni comparativ cu pacienții cu dezvoltare neurologică normală (Tabelul 5). În schimb, nivelurile de IL-12 au fost mai mici la nou-născuți, cu un rezultat anormal ulterior.
Tabel în dimensiune completă
DISCUŢIE
În cazul NE, creșterea citokinelor inflamatorii în serul neonatal a fost asociată cu alterarea metabolismului oxidativ al creierului neonatal și cu un rezultat neurologic anormal la vârsta de 30 de luni. Acest lucru este în concordanță cu observația noastră anterioară din această cohortă că nivelurile de citokine neonatale au fost crescute la copiii cu rezultate neuromotorii anormale la vârsta de 12 luni (3).
În mod similar, alții au descoperit că nivelurile de IL-6 și IL-8 în lichidul cefalorahidian (LCR) ale nou-născuților la termen se corelează cu gradul de encefalopatie, iar nivelurile de IL-6 se corelează cu rezultatele (1). Rezultatele noastre susțin studii recente la nou-născuții cu NE care au prezentat niveluri ridicate de IL-6 în plasmă și niveluri ridicate de IL-6 și TNF-α în comparație cu martorii. Raporturile ridicate CSF/plasmă pentru aceste citokine sugerează că acestea sunt produse în SNC în plus față de transportul lor peste bariera hematoencefalică (12). Termenul sugari născuți de mame cu corioamnionită clinică a atins cele mai mari concentrații plasmatice de IL-6, IL-8 și RANTES atunci când au prezentat NE și/sau convulsii (2).
Din câte știm, acesta este primul studiu care a investigat asocierea markerilor inflamatori sistemici cu metabolismul anaerob al creierului la nou-născuții umani după hipoxie-ischemie. La modelele animale de meningită bacteriană, în care metabolismul anaerob apare și în SNC, TNF-α și IL-1β se corelează cu nivelurile de lactat CSF (26) și TNF-α crește acidoză lactică în lichidul cefalorahidian prin reducerea aportului de oxigen cerebral și a sângelui cerebral flux (27). Asocierea citokinelor cu stresul oxidativ este susținută în continuare de observația noastră că citokinele pro-inflamatorii sunt asociate cu lactat crescut în DGN, dar nu și în zona WS. Studiile de rezonanță magnetică la nou-născuții cu NE arată că DGN este cea mai vulnerabilă regiune (8, 28, 29), corespunzătoare distribuției spațiale a lactatului, măsurată prin 1H-MRS (9, 30). Citokinele măsurate nu au fost asociate cu anomalii structurale detectate prin RMN. Este posibil ca examinările MR neonatale timpurii să nu fie suficient de sensibile pentru a detecta leziuni structurale ușoare.
Prezența convulsiilor neonatale la nou-născuții encefalopatici la termen este un indicator fiabil al rezultatului neurologic slab (31, 32). După cum se arată mai sus, creșterea severității convulsiilor neonatale a fost asociată în mod independent cu daune structurale și creșterea nivelului de lactat/colină în substanța cenușie profundă și zonele bazinului (33). Nivelurile de citokine nu au fost asociate cu severitatea convulsiilor neonatale și, prin urmare, este puțin probabil ca asocierea citokinelor cu alterarea metabolismului creierului să fie confundată de prezența convulsiilor.
Descoperirea noastră că citokinele neonatale crescute sunt asociate cu dezvoltarea neurologică este în concordanță cu constatările lui Nelson și colab. (4) niveluri mai ridicate de IL-1β, IL-8, IL-9, TNF-α și RANTES la majoritatea nou-născuților care au dezvoltat ulterior paralizie cerebrală (CP). Cu toate acestea, la sugarii foarte prematuri, nivelurile de citokine neonatale nu au diferențiat între CP și copiii mici (34). Un studiu recent efectuat pe 78 de bio-markeri și sugari prematuri măsurați la termen, care s-au dezvoltat ulterior, a arătat că modelul markerilor inflamatori diferă în cele două populații (35), sugerând căile responsabile de modificarea leziunilor cerebrale cu maturitatea. Studiul nostru anterior asupra cohortei actuale de 12 luni a arătat că copiii cu rezultate neuromotorii anormale au avut niveluri neonatale crescute de IL-6, IL-8 și IL-9 comparativ cu copiii cu dezvoltare motorie normală (3). Studiul nostru actual de 30 de ani a constatat o asociere a markerilor inflamatori neonatali cu neurodezvoltarea, care include măsuri cognitive în plus față de rezultatele cognitive, deoarece NE poate duce la afectarea în fiecare dintre aceste zone.
Deși precizia și fiabilitatea măsurării spectrului de substanțe din probele de sânge neonatal de arhivă au fost determinate anterior (3, 4), dezavantajul acestei metode este că oferă doar o imagine a cascadei inflamatorii în momentul recoltării sângelui. Fereastra largă de timp a colectării sângelui (1 - 8 d) și a studiului MR (2 - 16 d) este o limitare a studiului curent, deși această măsurare ne-a influențat rezultatele spre ipoteza nulă. Datorită acestei abateri de măsurare, am putea subestima sau trece cu vederea asocierea dintre citokinele serice și metabolismul creierului sau dezvoltarea neurologică. Având în vedere numărul de citokine măsurate, este important de remarcat consistența asocierii nivelurilor de citokine cu lactatul/colina în DGN și nu în regiunea WS. Datorită suprapunerii mari în distribuția nivelurilor de citokine între grupurile de producție normale și anormale, acești markeri inflamatori, în mod izolat, nu sunt predictori pronostici puternici ai rezultatelor dezvoltării neurologice. Este nevoie de teste suplimentare cu biomarkeri seriali și măsuri RMN pentru a evalua relația dintre markerii pro și antiinflamatori cu sincronizarea leziunilor și modul în care acești markeri sunt interconectați și se schimbă în timp.
Într-un studiu de cohortă, nu putem dovedi o relație de cauzalitate între mediul inflamator, NE și deteriorarea ulterioară a sistemului nervos. Relația dintre acești factori poate fi diferită de infecția neonatală sistemică sau corioamnionita. Sunt necesare studii suplimentare pentru a examina dacă modularea acestei căi la termenul nou-născut uman va îmbunătăți rezultatele cognitive și motorii.
abrevieri
miezuri cenușii profunde
oxidarea membranei extracorporale
spectroscopie de rezonanță magnetică a protonilor
- Rezultate fascinante ale cercetării Biscuiții sunt mai dependenți decât cocaina
- Finanțare normativă Ministerul Educației, Științei, Cercetării și Sportului din Republica Slovacă
- Au găsit carne de origine braziliană Podbrezovan
- O mină de diamante inundată în Siberia, Rusia Soarta a 9 mineri este neclară
- Descoperirile fascinante ale oamenilor de știință Această băutură este foarte periculoasă pentru femei!
